よむ、つかう、まなぶ。
資料2-2 チェストベリー乾燥エキスのリスク区分について (36 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29975.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和4年度第22回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
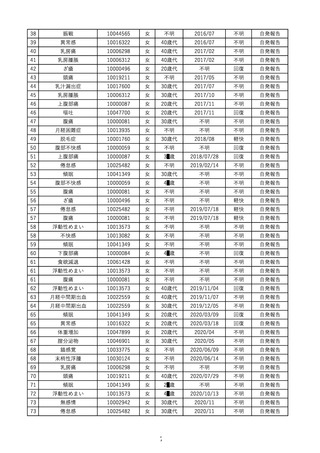
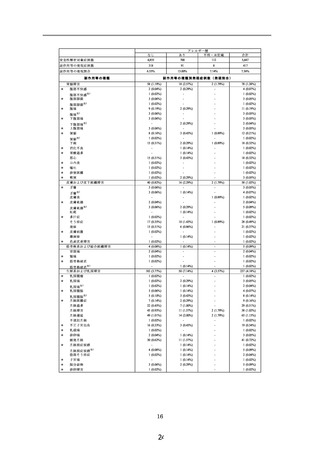
安全性解析対象症例数
副作用等の発現症例数
副作用等の発現割合
0< ≦ 30
2,462
*
65
121
21
0
417
6.60%
6.81%
4.77%
0.00%
7.36%
*
6 (1.36%)
-
58 (1.02%)
-
-
-
3 (0.05%)
-
-
-
4 (0.07%)
-
-
-
1 (0.02%)
1 (0.10%)
-
-
-
2 (0.04%)
3 (0.12%)
2 (0.20%)
-
-
-
5 (0.09%)
)
多汗症
2 (0.20%)
7 (0.39%)
1 (0.04%)
1 (0.04%)
-
-
-
-
-
1 (0.06%)
1 (0.23%)
-
-
1 (0.02%)
-
1 (0.02%)
そう痒症
17 (0.69%)
1 (0.10%)
6 (0.34%)
4 (0.91%)
-
28 (0.49%)
発疹
16 (0.65%)
1 (0.10%)
1 (0.06%)
3 (0.68%)
-
21 (0.37%)
-
皮膚刺激
1 (0.04%)
-
色素沈着障害
筋骨格系および結合組織障害
3 (0.12%)
2 (0.08%)
背部痛
-
*
顎痛
*
筋骨格硬直
1 (0.04%)
)
筋骨格硬直 注
生殖系および乳房障害
101 (4.10%)
*
乳房腫瘤
1 (0.04%)
*
乳房痛
1 (0.04%)
*
乳房痛 注
乳房腫脹
*
1 (0.10%)
2 (0.20%)
1 (0.10%)
1 (0.10%)
39 (3.96%)
2 (0.20%)
-
-
-
1 (0.02%)
-
-
-
1 (0.02%)
-
1 (0.02%)
-
-
-
-
5 (0.09%)
-
-
-
2 (0.04%)
-
-
-
1 (0.02%)
-
-
-
1 (0.02%)
82 (4.61%)
1 (0.23%)
15 (3.41%)
-
1 (0.02%)
-
237 (4.18%)
-
-
-
1 (0.02%)
-
-
-
3 (0.05%)
1 (0.04%)
1 (0.10%)
2 (0.08%)
1 (0.10%)
乳房腫脹 注
月経困難症
5 (0.20%)
3 (0.30%)
3 (0.12%)
2 (0.20%)
3 (0.17%)
1 (0.23%)
-
9 (0.16%)
月経過多
9 (0.37%)
9 (0.91%)
8 (0.45%)
3 (0.68%)
-
29 (0.51%)
月経障害
26 (1.06%)
8 (0.81%)
19 (1.07%)
5 (1.14%)
-
58 (1.02%)
月経遅延
27 (1.10%)
14 (1.42%)
22 (1.24%)
2 (0.45%)
-
65 (1.15%)
)
)
-
不規則月経
*
不正子宮出血
*
乳頭痛
*
排卵痛
13 (0.53%)
2 (0.08%)
15 (0.61%)
頻発月経
*
-
皮膚乾燥
蕁麻疹
*
7 (0.71%)
2 (0.08%)
皮膚乾燥 注
紅斑
*
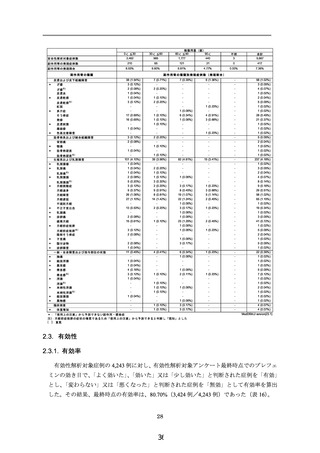
副作用等の種類別発現症例数(発現割合)
38 (1.54%)
ざ瘡 注
皮膚炎
)
*
合計
5,667
210
3 (0.12%)
ざ瘡
不明
3
8.53%
副作用等の種類
皮膚および皮下組織障害
総服用量(錠)
60< ≦ 90
90<
1,777
440
30< ≦ 60
985
-
月経前症候群
月経前症候群 注
陰部そう痒症
)
2 (0.20%)
1 (0.06%)
-
1 (0.06%)
3 (0.17%)
-
2 (0.04%)
-
4 (0.07%)
-
-
8 (0.14%)
1 (0.23%)
-
1 (0.02%)
-
19 (0.34%)
1 (0.02%)
-
1 (0.06%)
-
-
-
1 (0.06%)
-
-
3 (0.05%)
-
41 (0.72%)
-
1 (0.02%)
1 (0.10%)
23 (1.29%)
-
1 (0.06%)
3 (0.12%)
-
1 (0.06%)
2 (0.08%)
-
-
-
-
2 (0.45%)
1 (0.23%)
-
5 (0.09%)
-
-
2 (0.04%)
1 (0.02%)
*
子宮痛
-
1 (0.06%)
-
-
*
腟分泌物
2 (0.08%)
-
3 (0.17%)
-
-
5 (0.09%)
*
排卵障害
1 (0.04%)
-
-
-
1 (0.02%)
-
22 (0.39%)
一般・全身障害および投与部位の状態
11 (0.45%)
-
4 (0.41%)
-
*
胸痛
*
顔面浮腫
1 (0.04%)
-
*
異常感
1 (0.04%)
-
*
倦怠感
4 (0.16%)
-
*
倦怠感 注
浮腫
*
浮腫 注
末梢性浮腫
*
末梢性浮腫 注
顔面腫脹
*
異物感
-
臨床検査
-
3 (0.12%)
)
1 (0.04%)
)
*
)
体重増加
1 (0.10%)
-
-
1 (0.10%)
-
1 (0.10%)
-
1 (0.10%)
1 (0.04%)
-
6 (0.34%)
1 (0.06%)
1 (0.23%)
-
-
1 (0.02%)
-
-
-
1 (0.02%)
-
-
-
1 (0.02%)
-
-
5 (0.09%)
1 (0.06%)
2 (0.11%)
1 (0.23%)
-
7 (0.12%)
-
-
-
1 (0.02%)
-
-
-
1 (0.02%)
-
-
2 (0.04%)
-
-
-
1 (0.02%)
-
1 (0.06%)
-
-
1 (0.02%)
1 (0.06%)
-
-
1 (0.02%)
1 (0.10%)
3 (0.17%)
-
-
4 (0.07%)
1 (0.10%)
3 (0.17%)
-
-
-
*:「使用上の注意」から予測できない副作用・感染症
注 ):月経前症候群の症状の増悪であるため「使用上の注意」から予測できると判断し「既知」とした
[ ]:重篤
4 (0.07%)
MedDRA/J version(23.1)
2.3. 有効性
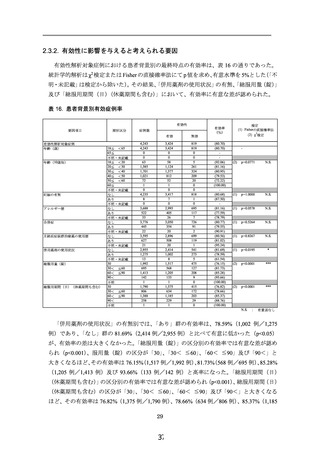
2.3.1. 有効率
有効性解析対象症例の 4,243 例に対し、有効性解析対象アンケート最終時点でのプレフェ
ミンの効き目で、
「よく効いた」、
「効いた」又は「少し効いた」と判断された症例を「有効」
とし、「変わらない」又は「悪くなった」と判断された症例を「無効」として有効率を算出
した。その結果、最終時点の有効率は、80.70%(3,424 例/4,243 例)であった(表 16)。
28
36
副作用等の発現症例数
副作用等の発現割合
0< ≦ 30
2,462
*
65
121
21
0
417
6.60%
6.81%
4.77%
0.00%
7.36%
*
6 (1.36%)
-
58 (1.02%)
-
-
-
3 (0.05%)
-
-
-
4 (0.07%)
-
-
-
1 (0.02%)
1 (0.10%)
-
-
-
2 (0.04%)
3 (0.12%)
2 (0.20%)
-
-
-
5 (0.09%)
)
多汗症
2 (0.20%)
7 (0.39%)
1 (0.04%)
1 (0.04%)
-
-
-
-
-
1 (0.06%)
1 (0.23%)
-
-
1 (0.02%)
-
1 (0.02%)
そう痒症
17 (0.69%)
1 (0.10%)
6 (0.34%)
4 (0.91%)
-
28 (0.49%)
発疹
16 (0.65%)
1 (0.10%)
1 (0.06%)
3 (0.68%)
-
21 (0.37%)
-
皮膚刺激
1 (0.04%)
-
色素沈着障害
筋骨格系および結合組織障害
3 (0.12%)
2 (0.08%)
背部痛
-
*
顎痛
*
筋骨格硬直
1 (0.04%)
)
筋骨格硬直 注
生殖系および乳房障害
101 (4.10%)
*
乳房腫瘤
1 (0.04%)
*
乳房痛
1 (0.04%)
*
乳房痛 注
乳房腫脹
*
1 (0.10%)
2 (0.20%)
1 (0.10%)
1 (0.10%)
39 (3.96%)
2 (0.20%)
-
-
-
1 (0.02%)
-
-
-
1 (0.02%)
-
1 (0.02%)
-
-
-
-
5 (0.09%)
-
-
-
2 (0.04%)
-
-
-
1 (0.02%)
-
-
-
1 (0.02%)
82 (4.61%)
1 (0.23%)
15 (3.41%)
-
1 (0.02%)
-
237 (4.18%)
-
-
-
1 (0.02%)
-
-
-
3 (0.05%)
1 (0.04%)
1 (0.10%)
2 (0.08%)
1 (0.10%)
乳房腫脹 注
月経困難症
5 (0.20%)
3 (0.30%)
3 (0.12%)
2 (0.20%)
3 (0.17%)
1 (0.23%)
-
9 (0.16%)
月経過多
9 (0.37%)
9 (0.91%)
8 (0.45%)
3 (0.68%)
-
29 (0.51%)
月経障害
26 (1.06%)
8 (0.81%)
19 (1.07%)
5 (1.14%)
-
58 (1.02%)
月経遅延
27 (1.10%)
14 (1.42%)
22 (1.24%)
2 (0.45%)
-
65 (1.15%)
)
)
-
不規則月経
*
不正子宮出血
*
乳頭痛
*
排卵痛
13 (0.53%)
2 (0.08%)
15 (0.61%)
頻発月経
*
-
皮膚乾燥
蕁麻疹
*
7 (0.71%)
2 (0.08%)
皮膚乾燥 注
紅斑
*
副作用等の種類別発現症例数(発現割合)
38 (1.54%)
ざ瘡 注
皮膚炎
)
*
合計
5,667
210
3 (0.12%)
ざ瘡
不明
3
8.53%
副作用等の種類
皮膚および皮下組織障害
総服用量(錠)
60< ≦ 90
90<
1,777
440
30< ≦ 60
985
-
月経前症候群
月経前症候群 注
陰部そう痒症
)
2 (0.20%)
1 (0.06%)
-
1 (0.06%)
3 (0.17%)
-
2 (0.04%)
-
4 (0.07%)
-
-
8 (0.14%)
1 (0.23%)
-
1 (0.02%)
-
19 (0.34%)
1 (0.02%)
-
1 (0.06%)
-
-
-
1 (0.06%)
-
-
3 (0.05%)
-
41 (0.72%)
-
1 (0.02%)
1 (0.10%)
23 (1.29%)
-
1 (0.06%)
3 (0.12%)
-
1 (0.06%)
2 (0.08%)
-
-
-
-
2 (0.45%)
1 (0.23%)
-
5 (0.09%)
-
-
2 (0.04%)
1 (0.02%)
*
子宮痛
-
1 (0.06%)
-
-
*
腟分泌物
2 (0.08%)
-
3 (0.17%)
-
-
5 (0.09%)
*
排卵障害
1 (0.04%)
-
-
-
1 (0.02%)
-
22 (0.39%)
一般・全身障害および投与部位の状態
11 (0.45%)
-
4 (0.41%)
-
*
胸痛
*
顔面浮腫
1 (0.04%)
-
*
異常感
1 (0.04%)
-
*
倦怠感
4 (0.16%)
-
*
倦怠感 注
浮腫
*
浮腫 注
末梢性浮腫
*
末梢性浮腫 注
顔面腫脹
*
異物感
-
臨床検査
-
3 (0.12%)
)
1 (0.04%)
)
*
)
体重増加
1 (0.10%)
-
-
1 (0.10%)
-
1 (0.10%)
-
1 (0.10%)
1 (0.04%)
-
6 (0.34%)
1 (0.06%)
1 (0.23%)
-
-
1 (0.02%)
-
-
-
1 (0.02%)
-
-
-
1 (0.02%)
-
-
5 (0.09%)
1 (0.06%)
2 (0.11%)
1 (0.23%)
-
7 (0.12%)
-
-
-
1 (0.02%)
-
-
-
1 (0.02%)
-
-
2 (0.04%)
-
-
-
1 (0.02%)
-
1 (0.06%)
-
-
1 (0.02%)
1 (0.06%)
-
-
1 (0.02%)
1 (0.10%)
3 (0.17%)
-
-
4 (0.07%)
1 (0.10%)
3 (0.17%)
-
-
-
*:「使用上の注意」から予測できない副作用・感染症
注 ):月経前症候群の症状の増悪であるため「使用上の注意」から予測できると判断し「既知」とした
[ ]:重篤
4 (0.07%)
MedDRA/J version(23.1)
2.3. 有効性
2.3.1. 有効率
有効性解析対象症例の 4,243 例に対し、有効性解析対象アンケート最終時点でのプレフェ
ミンの効き目で、
「よく効いた」、
「効いた」又は「少し効いた」と判断された症例を「有効」
とし、「変わらない」又は「悪くなった」と判断された症例を「無効」として有効率を算出
した。その結果、最終時点の有効率は、80.70%(3,424 例/4,243 例)であった(表 16)。
28
36