よむ、つかう、まなぶ。
資料2-2 チェストベリー乾燥エキスのリスク区分について (34 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29975.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和4年度第22回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
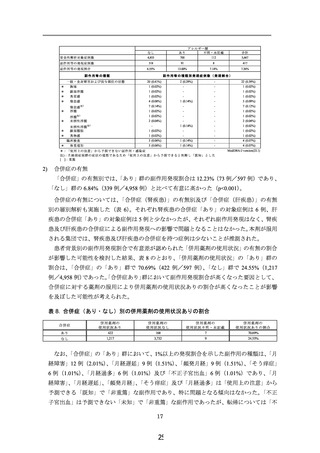
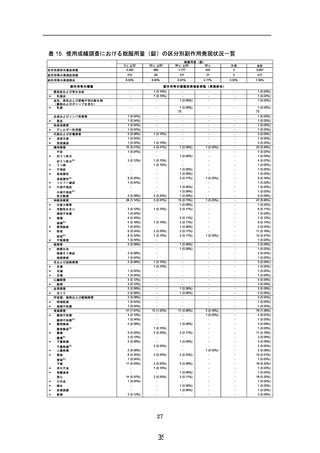
安全性解析対象症例数
副作用等の発現症例数
副作用等の発現割合
併用薬剤の使用状況
あり
不明・未記載
1,672
17
なし
3,978
合計
5,667
244
171
2
417
6.13%
10.23%
11.76%
7.36%
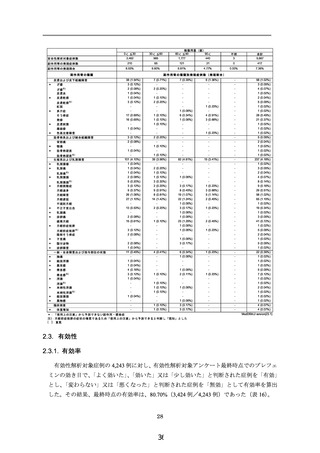
副作用等の種類
副作用等の種類別発現症例数(発現割合)
-
22 (0.39%)
*
胸痛
1 (0.03%)
-
-
1 (0.02%)
*
顔面浮腫
1 (0.03%)
-
-
1 (0.02%)
*
異常感
1 (0.06%)
-
1 (0.02%)
4 (0.10%)
1 (0.06%)
-
5 (0.09%)
3 (0.08%)
4 (0.24%)
-
7 (0.12%)
一般・全身障害および投与部位の状態
-
*
倦怠感
*
倦怠感 注
浮腫
*
浮腫 注
末梢性浮腫
*
末梢性浮腫 注
顔面腫脹
*
)
6 (0.36%)
1 (0.03%)
-
-
1 (0.02%)
1 (0.03%)
-
-
1 (0.02%)
2 (0.05%)
-
-
2 (0.04%)
1 (0.03%)
-
-
1 (0.02%)
1 (0.03%)
-
-
1 (0.02%)
異物感
1 (0.03%)
-
-
1 (0.02%)
臨床検査
4 (0.10%)
-
-
4 (0.07%)
4 (0.10%)
-
-
4 (0.07%)
)
*
16 (0.40%)
)
体重増加
MedDRA/J version(23.1)
*:「使用上の注意」から予測できない副作用・感染症
注):月経前症候群の症状の増悪であるため「使用上の注意」から予測できると判断し「既知」とした
[ ]:重篤
5)
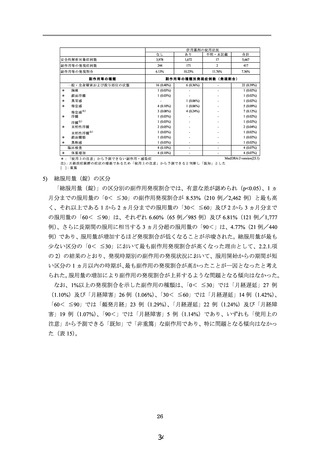
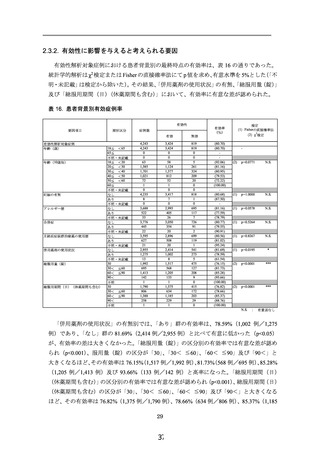
総服用量(錠)の区分
「総服用量(錠)」の区分別の副作用発現割合では、有意な差が認められ(p<0.05)、1 ヵ
月分までの服用量の「0< ≦30」の副作用発現割合が 8.53%(210 例/2,462 例)と最も高
く、それ以上である 1 から 2 ヵ月分までの服用量の「30< ≦60」及び 2 から 3 ヵ月分まで
の服用量の「60< ≦90」は、それぞれ 6.60%(65 例/985 例)及び 6.81%(121 例/1,777
例)、さらに長期間の服用に相当する 3 ヵ月分超の服用量の「90<」は、4.77%(21 例/440
例)であり、服用量が増加するほど発現割合が低くなることが示唆された。総服用量が最も
少ない区分の「0< ≦30」において最も副作用発現割合が高くなった理由として、2.2.1.項
の 2)の結果のとおり、発現時期別の副作用の発現状況において、服用開始からの期間が短
い区分の 1 ヵ月以内の時期が、最も副作用の発現割合が高かったことが一因となったと考え
られた。服用量の増加により副作用の発現割合が上昇するような問題となる傾向はなかった。
なお、1%以上の発現割合を示した副作用の種類は、「0< ≦30」では「月経遅延」27 例
(1.10%)及び「月経障害」26 例(1.06%)、
「30< ≦60」では「月経遅延」14 例(1.42%)、
「60< ≦90」では「頻発月経」23 例(1.29%)、
「月経遅延」22 例(1.24%)及び「月経障
害」19 例(1.07%)、「90<」では「月経障害」5 例(1.14%)であり、いずれも「使用上の
注意」から予測できる「既知」で「非重篤」な副作用であり、特に問題となる傾向はなかっ
た(表 15)。
26
34
副作用等の発現症例数
副作用等の発現割合
併用薬剤の使用状況
あり
不明・未記載
1,672
17
なし
3,978
合計
5,667
244
171
2
417
6.13%
10.23%
11.76%
7.36%
副作用等の種類
副作用等の種類別発現症例数(発現割合)
-
22 (0.39%)
*
胸痛
1 (0.03%)
-
-
1 (0.02%)
*
顔面浮腫
1 (0.03%)
-
-
1 (0.02%)
*
異常感
1 (0.06%)
-
1 (0.02%)
4 (0.10%)
1 (0.06%)
-
5 (0.09%)
3 (0.08%)
4 (0.24%)
-
7 (0.12%)
一般・全身障害および投与部位の状態
-
*
倦怠感
*
倦怠感 注
浮腫
*
浮腫 注
末梢性浮腫
*
末梢性浮腫 注
顔面腫脹
*
)
6 (0.36%)
1 (0.03%)
-
-
1 (0.02%)
1 (0.03%)
-
-
1 (0.02%)
2 (0.05%)
-
-
2 (0.04%)
1 (0.03%)
-
-
1 (0.02%)
1 (0.03%)
-
-
1 (0.02%)
異物感
1 (0.03%)
-
-
1 (0.02%)
臨床検査
4 (0.10%)
-
-
4 (0.07%)
4 (0.10%)
-
-
4 (0.07%)
)
*
16 (0.40%)
)
体重増加
MedDRA/J version(23.1)
*:「使用上の注意」から予測できない副作用・感染症
注):月経前症候群の症状の増悪であるため「使用上の注意」から予測できると判断し「既知」とした
[ ]:重篤
5)
総服用量(錠)の区分
「総服用量(錠)」の区分別の副作用発現割合では、有意な差が認められ(p<0.05)、1 ヵ
月分までの服用量の「0< ≦30」の副作用発現割合が 8.53%(210 例/2,462 例)と最も高
く、それ以上である 1 から 2 ヵ月分までの服用量の「30< ≦60」及び 2 から 3 ヵ月分まで
の服用量の「60< ≦90」は、それぞれ 6.60%(65 例/985 例)及び 6.81%(121 例/1,777
例)、さらに長期間の服用に相当する 3 ヵ月分超の服用量の「90<」は、4.77%(21 例/440
例)であり、服用量が増加するほど発現割合が低くなることが示唆された。総服用量が最も
少ない区分の「0< ≦30」において最も副作用発現割合が高くなった理由として、2.2.1.項
の 2)の結果のとおり、発現時期別の副作用の発現状況において、服用開始からの期間が短
い区分の 1 ヵ月以内の時期が、最も副作用の発現割合が高かったことが一因となったと考え
られた。服用量の増加により副作用の発現割合が上昇するような問題となる傾向はなかった。
なお、1%以上の発現割合を示した副作用の種類は、「0< ≦30」では「月経遅延」27 例
(1.10%)及び「月経障害」26 例(1.06%)、
「30< ≦60」では「月経遅延」14 例(1.42%)、
「60< ≦90」では「頻発月経」23 例(1.29%)、
「月経遅延」22 例(1.24%)及び「月経障
害」19 例(1.07%)、「90<」では「月経障害」5 例(1.14%)であり、いずれも「使用上の
注意」から予測できる「既知」で「非重篤」な副作用であり、特に問題となる傾向はなかっ
た(表 15)。
26
34