よむ、つかう、まなぶ。
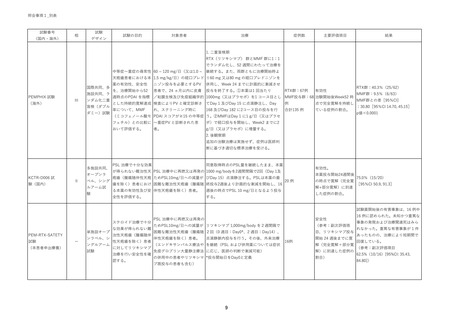
患-2○患者申出療養の総括報告書に関する評価について (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00025.html |
| 出典情報 | 患者申出療養評価会議(第41回 6/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
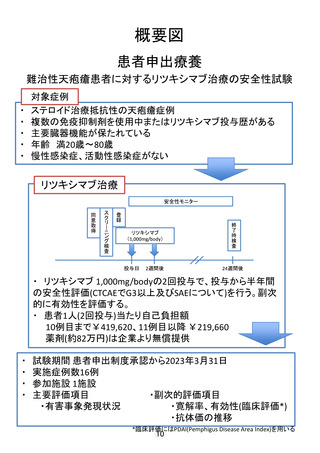
概要図
患者申出療養
難治性天疱瘡患者に対するリツキシマブ治療の安全性試験
・
・
・
・
・
対象症例
ステロイド治療抵抗性の天疱瘡症例
複数の免疫抑制剤を使用中またはリツキシマブ投与歴がある
主要臓器機能が保たれている
年齢 満20歳〜80歳
慢性感染症、活動性感染症がない
リツキシマブ治療
・ リツキシマブ 1,000mg/bodyの2回投与で、投与から半年間
の安全性評価(CTCAEでG3以上及びSAEについて)を行う。副次
的に有効性を評価する。
・ 患者1人(2回投与)当たり自己負担額
10例目まで¥419,620、11例目以降 ¥219,660
薬剤(約82万円)は企業より無償提供
・
・
・
・
試験期間 患者申出制度承認から2023年3月31日
実施症例数16例
参加施設 1施設
主要評価項目
・副次的評価項目
・有害事象発現状況
・寛解率、有効性(臨床評価*)
・抗体価の推移
*臨床評価にはPDAI(Pemphigus Disease Area Index)を用いる
10
患者申出療養
難治性天疱瘡患者に対するリツキシマブ治療の安全性試験
・
・
・
・
・
対象症例
ステロイド治療抵抗性の天疱瘡症例
複数の免疫抑制剤を使用中またはリツキシマブ投与歴がある
主要臓器機能が保たれている
年齢 満20歳〜80歳
慢性感染症、活動性感染症がない
リツキシマブ治療
・ リツキシマブ 1,000mg/bodyの2回投与で、投与から半年間
の安全性評価(CTCAEでG3以上及びSAEについて)を行う。副次
的に有効性を評価する。
・ 患者1人(2回投与)当たり自己負担額
10例目まで¥419,620、11例目以降 ¥219,660
薬剤(約82万円)は企業より無償提供
・
・
・
・
試験期間 患者申出制度承認から2023年3月31日
実施症例数16例
参加施設 1施設
主要評価項目
・副次的評価項目
・有害事象発現状況
・寛解率、有効性(臨床評価*)
・抗体価の推移
*臨床評価にはPDAI(Pemphigus Disease Area Index)を用いる
10