よむ、つかう、まなぶ。
患-2○患者申出療養の総括報告書に関する評価について (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00025.html |
| 出典情報 | 患者申出療養評価会議(第41回 6/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
患者申出療養総括報告書の指摘事項に対する回答
患者申出療養技術名:難治性天疱瘡患者に対するリツキシマブ治療
令和5年6月21日
所属・氏名:慶應義塾大学病院 舩越 建
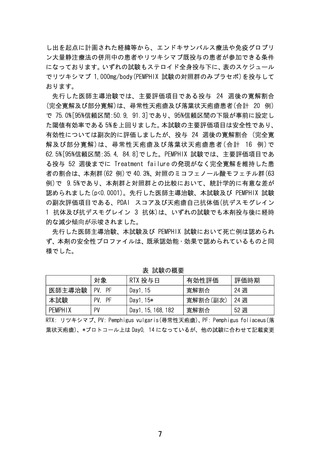
1.本試験と先行した医師主導治験、海外で実施された臨床試験(US label に記載
されている二つの試験の両方、あるいは少なくとも RCT)の違いについて説明して
ください。試験デザインの違い、対象患者の違い(キーとなる組み入れ、除外基準、
N 数)、リツキシマブの投与方法(用量、回数など)の違い、有効性のエンドポイン
トの違いとその結果、(もしあれば)安全性での特記事項、などについてご教示く
ださい。(可能であれば、簡単な表にまとめていただければありがたいです。)
【回答】
お問い合わせいただきました内容のうち、国内の承認申請時に有効性及び安
全性に関する評価資料としては、既に PMDA のホームページ上に審査報告書
(2021 年 12 月 24 日承認分)及び申請資料概要が掲載されており海外 PEMPHIX
試験(PⅢ)、先行した国内医師主導治験である KCTR-D006 試験(PⅡ)の詳細
が公表されております。
・審査報告書
https://www.pmda.go.jp/drugs/2021/P20211215002/380101000_23000AMX001
85_A100_1.pdf
・申請資料概要
https://www.pmda.go.jp/drugs/2021/P20211215002/index.html
概略は以下に示しますが別表も作成しております。詳細は公表資料をご参照
ください。
前述しましたように、国内における本剤の申請は、先行した医師主導治験(P
Ⅱ)及び PEMPHIX 試験(PⅢ)に基づくため、これらの試験について回答いたし
ます。先行した医師主導治験は、再燃・再発のためプレドニゾロンの用量を治療
目標である 10 mg/日以下に減量困難な天疱瘡(尋常性天疱瘡及び落葉状天疱瘡)
患者を、PEMPHIX 試験は、治療導入期に標準的経口ステロイド治療では病勢が制
御できない中等症から重症の尋常性天疱瘡患者を対象に実施されました。本試
験は、先行した医師主導治験の適格・除外基準の一部を満たさない患者からの申
6
患者申出療養技術名:難治性天疱瘡患者に対するリツキシマブ治療
令和5年6月21日
所属・氏名:慶應義塾大学病院 舩越 建
1.本試験と先行した医師主導治験、海外で実施された臨床試験(US label に記載
されている二つの試験の両方、あるいは少なくとも RCT)の違いについて説明して
ください。試験デザインの違い、対象患者の違い(キーとなる組み入れ、除外基準、
N 数)、リツキシマブの投与方法(用量、回数など)の違い、有効性のエンドポイン
トの違いとその結果、(もしあれば)安全性での特記事項、などについてご教示く
ださい。(可能であれば、簡単な表にまとめていただければありがたいです。)
【回答】
お問い合わせいただきました内容のうち、国内の承認申請時に有効性及び安
全性に関する評価資料としては、既に PMDA のホームページ上に審査報告書
(2021 年 12 月 24 日承認分)及び申請資料概要が掲載されており海外 PEMPHIX
試験(PⅢ)、先行した国内医師主導治験である KCTR-D006 試験(PⅡ)の詳細
が公表されております。
・審査報告書
https://www.pmda.go.jp/drugs/2021/P20211215002/380101000_23000AMX001
85_A100_1.pdf
・申請資料概要
https://www.pmda.go.jp/drugs/2021/P20211215002/index.html
概略は以下に示しますが別表も作成しております。詳細は公表資料をご参照
ください。
前述しましたように、国内における本剤の申請は、先行した医師主導治験(P
Ⅱ)及び PEMPHIX 試験(PⅢ)に基づくため、これらの試験について回答いたし
ます。先行した医師主導治験は、再燃・再発のためプレドニゾロンの用量を治療
目標である 10 mg/日以下に減量困難な天疱瘡(尋常性天疱瘡及び落葉状天疱瘡)
患者を、PEMPHIX 試験は、治療導入期に標準的経口ステロイド治療では病勢が制
御できない中等症から重症の尋常性天疱瘡患者を対象に実施されました。本試
験は、先行した医師主導治験の適格・除外基準の一部を満たさない患者からの申
6