よむ、つかう、まなぶ。
患-2○患者申出療養の総括報告書に関する評価について (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00025.html |
| 出典情報 | 患者申出療養評価会議(第41回 6/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
疾患活動性の軽減とPSL量の減量が可能になることが期待
される。本研究の主要評価項目は安全性であり、現在実施中
の医師主導治験が薬事承認申請を行う際の参考データとして
使用できる予定。
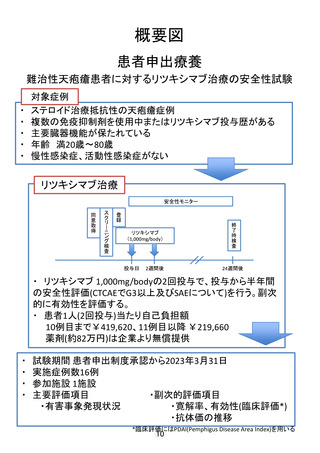
(患者申出療養に係る費用)
本医療技術に係る総費用は1,589,547円である。患者申出療
養にかかる費用は1,456,237円で、このうち補助金負担分は
232,100円、企業負担は819,517円となり、患者負担額は
404,620円である。
医療技術の試験結果
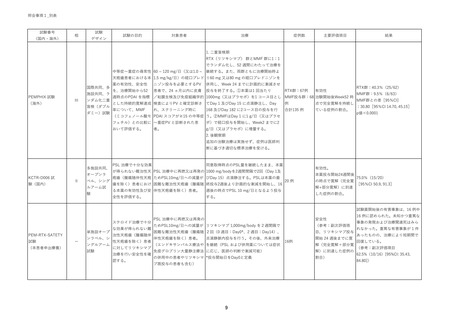
安全性の評価結果:
試験薬開始後の有害事象は、16 例中 16 例に認められた。
未知かつ重篤な事象の発現および治療関連死はみられなかっ
た。重篤な有害事象が 1 件あったものの、治療により短期間で
回復している。
有効性の評価結果:
全 16 例のうち 10 例が寛解に至り、寛解率は 62.5%[95%CI:
35.43, 84.80]であった。また、全症例において臨床スコアである
PDAI の低下が観察され、かつ、ステロイド投与量が不変であ
った 3 例を除く 13 例において減量することができた。
既存治療にリツキシマブ投与を行うことで、病状の改善が得
られ、ステロイドの減量も可能となることが明らかとなり、患者
背景に依らない普遍的に有効な治療である可能性が示唆され
た。
発生した有害事象:
重篤な有害事象として、1 件(1 例において 1 件)を報告した。
内容は、肺炎であった。これは試験薬に関連した既知の事象で
あり、抗生剤投与にて回復した。
本患者申出療養で、日本人の難治性天疱瘡患者に対するリ
ツキシマブ投与は、有効かつ安全であることが示された。本臨
床試験を通じたエビデンスの創出が、国内外の診療ガイドライ
ンへの反映などを経て、希少疾患における診療水準の向上に
貢献することが期待される。
臨床研究登録ID
jRCTs031180405
2
される。本研究の主要評価項目は安全性であり、現在実施中
の医師主導治験が薬事承認申請を行う際の参考データとして
使用できる予定。
(患者申出療養に係る費用)
本医療技術に係る総費用は1,589,547円である。患者申出療
養にかかる費用は1,456,237円で、このうち補助金負担分は
232,100円、企業負担は819,517円となり、患者負担額は
404,620円である。
医療技術の試験結果
安全性の評価結果:
試験薬開始後の有害事象は、16 例中 16 例に認められた。
未知かつ重篤な事象の発現および治療関連死はみられなかっ
た。重篤な有害事象が 1 件あったものの、治療により短期間で
回復している。
有効性の評価結果:
全 16 例のうち 10 例が寛解に至り、寛解率は 62.5%[95%CI:
35.43, 84.80]であった。また、全症例において臨床スコアである
PDAI の低下が観察され、かつ、ステロイド投与量が不変であ
った 3 例を除く 13 例において減量することができた。
既存治療にリツキシマブ投与を行うことで、病状の改善が得
られ、ステロイドの減量も可能となることが明らかとなり、患者
背景に依らない普遍的に有効な治療である可能性が示唆され
た。
発生した有害事象:
重篤な有害事象として、1 件(1 例において 1 件)を報告した。
内容は、肺炎であった。これは試験薬に関連した既知の事象で
あり、抗生剤投与にて回復した。
本患者申出療養で、日本人の難治性天疱瘡患者に対するリ
ツキシマブ投与は、有効かつ安全であることが示された。本臨
床試験を通じたエビデンスの創出が、国内外の診療ガイドライ
ンへの反映などを経て、希少疾患における診療水準の向上に
貢献することが期待される。
臨床研究登録ID
jRCTs031180405
2