よむ、つかう、まなぶ。
患-2○患者申出療養の総括報告書に関する評価について (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00025.html |
| 出典情報 | 患者申出療養評価会議(第41回 6/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
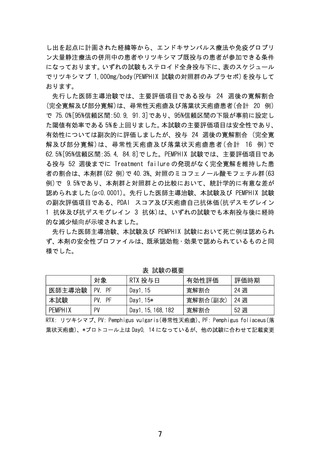
照会事項1_別表
試験番号
(国内・海外)
試験
相
デザイン
試験の目的
対象患者
治療
症例数
主要評価項目
結果
1. 二重盲検期
RTX(リツキシマブ) 群とMMF 群に1:1
でランダム化し、52 週間にわたって治療を
中等症~重症の尋常性 60 ~ 120 mg/日(又は1.0 ~
継続する。また、両群ともに治療開始時よ
天疱瘡患者における本 1.5 mg/kg/日)の経口プレド り60 mg 又は80 mg の経口プレドニゾンを
国際共同、多
PEMPHIX 試験
(海外)
施設共同、ラ
III
ンダム化二重
盲検(ダブル
ダミー)試験
薬の有効性、安全性
ニゾン投与を必要とするPV
併用し、Week 24 までに計画的に漸減させ
を、治療開始から52
患者で、24 ヵ月以内に皮膚
投与を終了する。①本薬は1 回当たり
RTX群:67例
有効性
週時点のPDAI を指標 /粘膜生検及び免疫組織学的 1000mg(又はプラセボ)を1 コース目とし MMF投与群:68 治験開始後Week52 時
とした持続的寛解達成 検査によりPV と確定診断さ てDay 1 及びDay 15 に点滴静注し、Day
例
点で完全寛解を持続し
率について、MMF
合計135 例
ている症例の割合。
れ、スクリーニング時に
168 及びDay 182 に2コース目の投与を行
(ミコフェノール酸モ PDAI スコアが≧15 の中等症 う。②MMFはDay 1 に1 g/日(又はプラセ
フェチル)との比較に ~重症PV と診断された患
ボ)で経口投与を開始し、Week2 までに2
おいて評価する。
g/日(又はプラセボ)に増量する。
者。
RTX群:40.3%(25/62)
MMF群:9.5%(6/63)
MMF群との差[95%CI]
:30.80[95%CI 14.70, 45.15]
p値<0.0001
2. 後観察期
追加の治験治療は実施せず、症例は医師判
断に基づき適切な標準治療を受ける。
多施設共同、
KCTR-D006 試
験(国内)
オープンラ
II
ベル、シング
ルアーム試
験
PSL 治療で十分な効果
同意取得時点のPSL量を継続したまま、本薬
有効性。
が得られない難治性天 PSL 治療中に再燃又は再発の 1000 mg/bodyを2週間間隔で2回(Day 1及
疱瘡(腫瘍随伴性天疱 ためPSL10mg/日への減量が びDay 15)点滴静注する。PSLは本薬の最
瘡を除く)患者におけ 困難な難治性天疱瘡(腫瘍随 終投与2週後より計画的な漸減を開始し、16
る本薬の有効性及び安 伴性天疱瘡を除く)患者。
週後の時点でPSL 10 mg/日となるよう投与
全性を評価する。
する。
本薬投与開始24週間後
20 例
の時点で寛解(完全寛
解+部分寛解)に到達
75.0%(15/20)
[95%CI 50.9, 91.3]
した症例の割合。
試験薬開始後の有害事象は、16 例中
ステロイド治療で十分
単施設オープ
PEM-RTX-SATETY
試験
(本患者申出療養)
ー
ンラベル、シ
ングルアーム
試験
な効果が得られない難
治性天疱瘡(腫瘍随伴
性天疱瘡を除く)患者
に対してリツキシマブ
治療を行い安全性を確
認する。
PSL 治療中に再燃又は再発の
安全性
ためPSL10mg/日への減量が リツキシマブ 1,000mg/body を2週間隔で
(参考:副次評価項
困難な難治性天疱瘡(腫瘍随 2回(0 週目:Day0*、2 週目:Day14)、
目、リツキシマブ投与
伴性天疱瘡を除く)患者。
開始 24 週後までに寛
点滴静脈内投与を行う。その後、外来治療
(エンドキサンパルス療法や を継続(PSL および併用薬については症状
16例
解(完全寛解+部分寛
免疫グロブリン大量静注療法 に応じ、医師の判断で漸減可能)
解)に到達した症例の
の併用中の患者やリツキシマ *投与開始日をDay0と定義
割合)
ブ既投与の患者も含む)
9
16 例に認められた。未知かつ重篤な
事象の発現および治療関連死はみら
れなかった。重篤な有害事象が 1 件
あったものの、治療により短期間で
回復している。
(参考:副次評価項目
62.5%(10/16)[95%CI: 35.43,
84.80])
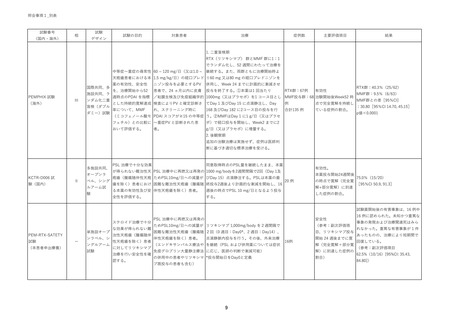
試験番号
(国内・海外)
試験
相
デザイン
試験の目的
対象患者
治療
症例数
主要評価項目
結果
1. 二重盲検期
RTX(リツキシマブ) 群とMMF 群に1:1
でランダム化し、52 週間にわたって治療を
中等症~重症の尋常性 60 ~ 120 mg/日(又は1.0 ~
継続する。また、両群ともに治療開始時よ
天疱瘡患者における本 1.5 mg/kg/日)の経口プレド り60 mg 又は80 mg の経口プレドニゾンを
国際共同、多
PEMPHIX 試験
(海外)
施設共同、ラ
III
ンダム化二重
盲検(ダブル
ダミー)試験
薬の有効性、安全性
ニゾン投与を必要とするPV
併用し、Week 24 までに計画的に漸減させ
を、治療開始から52
患者で、24 ヵ月以内に皮膚
投与を終了する。①本薬は1 回当たり
RTX群:67例
有効性
週時点のPDAI を指標 /粘膜生検及び免疫組織学的 1000mg(又はプラセボ)を1 コース目とし MMF投与群:68 治験開始後Week52 時
とした持続的寛解達成 検査によりPV と確定診断さ てDay 1 及びDay 15 に点滴静注し、Day
例
点で完全寛解を持続し
率について、MMF
合計135 例
ている症例の割合。
れ、スクリーニング時に
168 及びDay 182 に2コース目の投与を行
(ミコフェノール酸モ PDAI スコアが≧15 の中等症 う。②MMFはDay 1 に1 g/日(又はプラセ
フェチル)との比較に ~重症PV と診断された患
ボ)で経口投与を開始し、Week2 までに2
おいて評価する。
g/日(又はプラセボ)に増量する。
者。
RTX群:40.3%(25/62)
MMF群:9.5%(6/63)
MMF群との差[95%CI]
:30.80[95%CI 14.70, 45.15]
p値<0.0001
2. 後観察期
追加の治験治療は実施せず、症例は医師判
断に基づき適切な標準治療を受ける。
多施設共同、
KCTR-D006 試
験(国内)
オープンラ
II
ベル、シング
ルアーム試
験
PSL 治療で十分な効果
同意取得時点のPSL量を継続したまま、本薬
有効性。
が得られない難治性天 PSL 治療中に再燃又は再発の 1000 mg/bodyを2週間間隔で2回(Day 1及
疱瘡(腫瘍随伴性天疱 ためPSL10mg/日への減量が びDay 15)点滴静注する。PSLは本薬の最
瘡を除く)患者におけ 困難な難治性天疱瘡(腫瘍随 終投与2週後より計画的な漸減を開始し、16
る本薬の有効性及び安 伴性天疱瘡を除く)患者。
週後の時点でPSL 10 mg/日となるよう投与
全性を評価する。
する。
本薬投与開始24週間後
20 例
の時点で寛解(完全寛
解+部分寛解)に到達
75.0%(15/20)
[95%CI 50.9, 91.3]
した症例の割合。
試験薬開始後の有害事象は、16 例中
ステロイド治療で十分
単施設オープ
PEM-RTX-SATETY
試験
(本患者申出療養)
ー
ンラベル、シ
ングルアーム
試験
な効果が得られない難
治性天疱瘡(腫瘍随伴
性天疱瘡を除く)患者
に対してリツキシマブ
治療を行い安全性を確
認する。
PSL 治療中に再燃又は再発の
安全性
ためPSL10mg/日への減量が リツキシマブ 1,000mg/body を2週間隔で
(参考:副次評価項
困難な難治性天疱瘡(腫瘍随 2回(0 週目:Day0*、2 週目:Day14)、
目、リツキシマブ投与
伴性天疱瘡を除く)患者。
開始 24 週後までに寛
点滴静脈内投与を行う。その後、外来治療
(エンドキサンパルス療法や を継続(PSL および併用薬については症状
16例
解(完全寛解+部分寛
免疫グロブリン大量静注療法 に応じ、医師の判断で漸減可能)
解)に到達した症例の
の併用中の患者やリツキシマ *投与開始日をDay0と定義
割合)
ブ既投与の患者も含む)
9
16 例に認められた。未知かつ重篤な
事象の発現および治療関連死はみら
れなかった。重篤な有害事象が 1 件
あったものの、治療により短期間で
回復している。
(参考:副次評価項目
62.5%(10/16)[95%CI: 35.43,
84.80])