よむ、つかう、まなぶ。
患-2○患者申出療養の総括報告書に関する評価について (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00025.html |
| 出典情報 | 患者申出療養評価会議(第41回 6/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
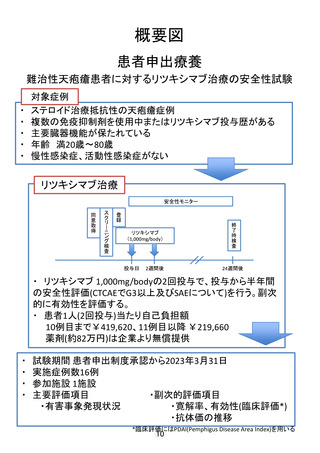
し出を起点に計画された経緯等から、エンドキサンパルス療法や免疫グロブリ
ン大量静注療法の併用中の患者やリツキシマブ既投与の患者が参加できる条件
になっております。いずれの試験もステロイド全身投与下に、表のスケジュール
でリツキシマブ 1,000mg/body(PEMPHIX 試験の対照群のみプラセボ)を投与して
おります。
先行した医師主導治験では、主要評価項目である投与 24 週後の寛解割合
(完全寛解及び部分寛解)は、尋常性天疱瘡及び落葉状天疱瘡患者(合計 20 例)
で 75.0%[95%信頼区間:50.9, 91.3]であり、95%信頼区間の下限が事前に設定し
た閾値有効率である 5%を上回りました。本試験の主要評価項目は安全性であり、
有効性については副次的に評価しましたが、投与 24 週後の寛解割合 (完全寛
解及び部分寛解)は、尋常性天疱瘡及び落葉状天疱瘡患者(合計 16 例)で
62.5%[95%信頼区間:35.4, 84.8]でした。PEMPHIX 試験では、主要評価項目であ
る投与 52 週後までに Treatment failure の発現がなく完全寛解を維持した患
者の割合は、本剤群(62 例)で 40.3%、対照のミコフェノール酸モフェチル群(63
例)で 9.5%であり、本剤群と対照群との比較において、統計学的に有意な差が
認められました(p<0.0001)。先行した医師主導治験、本試験及び PEMPHIX 試験
の副次評価項目である、PDAI スコア及び天疱瘡自己抗体価(抗デスモグレイン
1 抗体及び抗デスモグレイン 3 抗体)は、いずれの試験でも本剤投与後に経時
的な減少傾向が示唆されました。
先行した医師主導治験、本試験及び PEMPHIX 試験において死亡例は認められ
ず、本剤の安全性プロファイルは、既承認効能・効果で認められているものと同
様でした。
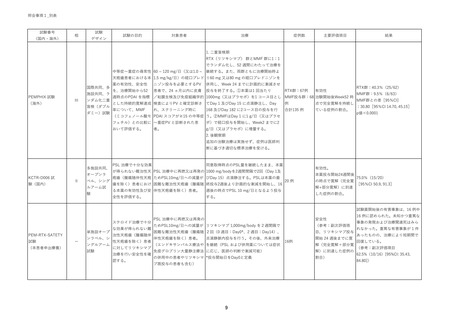
表 試験の概要
対象
RTX 投与日
有効性評価
評価時期
医師主導治験 PV, PF
Day1,15
寛解割合
24 週
本試験
PV, PF
Day1,15*
寛解割合(副次)
24 週
PEMPHIX
PV
Day1,15,168,182
寛解割合
52 週
RTX: リツキシマブ、PV: Pemphigus vulgaris(尋常性天疱瘡)、PF: Pemphigus foliaceus(落
葉状天疱瘡)、*プロトコール上は Day0, 14 になっているが、他の試験に合わせて記載変更
7
ン大量静注療法の併用中の患者やリツキシマブ既投与の患者が参加できる条件
になっております。いずれの試験もステロイド全身投与下に、表のスケジュール
でリツキシマブ 1,000mg/body(PEMPHIX 試験の対照群のみプラセボ)を投与して
おります。
先行した医師主導治験では、主要評価項目である投与 24 週後の寛解割合
(完全寛解及び部分寛解)は、尋常性天疱瘡及び落葉状天疱瘡患者(合計 20 例)
で 75.0%[95%信頼区間:50.9, 91.3]であり、95%信頼区間の下限が事前に設定し
た閾値有効率である 5%を上回りました。本試験の主要評価項目は安全性であり、
有効性については副次的に評価しましたが、投与 24 週後の寛解割合 (完全寛
解及び部分寛解)は、尋常性天疱瘡及び落葉状天疱瘡患者(合計 16 例)で
62.5%[95%信頼区間:35.4, 84.8]でした。PEMPHIX 試験では、主要評価項目であ
る投与 52 週後までに Treatment failure の発現がなく完全寛解を維持した患
者の割合は、本剤群(62 例)で 40.3%、対照のミコフェノール酸モフェチル群(63
例)で 9.5%であり、本剤群と対照群との比較において、統計学的に有意な差が
認められました(p<0.0001)。先行した医師主導治験、本試験及び PEMPHIX 試験
の副次評価項目である、PDAI スコア及び天疱瘡自己抗体価(抗デスモグレイン
1 抗体及び抗デスモグレイン 3 抗体)は、いずれの試験でも本剤投与後に経時
的な減少傾向が示唆されました。
先行した医師主導治験、本試験及び PEMPHIX 試験において死亡例は認められ
ず、本剤の安全性プロファイルは、既承認効能・効果で認められているものと同
様でした。
表 試験の概要
対象
RTX 投与日
有効性評価
評価時期
医師主導治験 PV, PF
Day1,15
寛解割合
24 週
本試験
PV, PF
Day1,15*
寛解割合(副次)
24 週
PEMPHIX
PV
Day1,15,168,182
寛解割合
52 週
RTX: リツキシマブ、PV: Pemphigus vulgaris(尋常性天疱瘡)、PF: Pemphigus foliaceus(落
葉状天疱瘡)、*プロトコール上は Day0, 14 になっているが、他の試験に合わせて記載変更
7