よむ、つかう、まなぶ。
資料2-1 令和4年度の安全対策について [774KB] (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_33888.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和5年度第1回 6/29)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
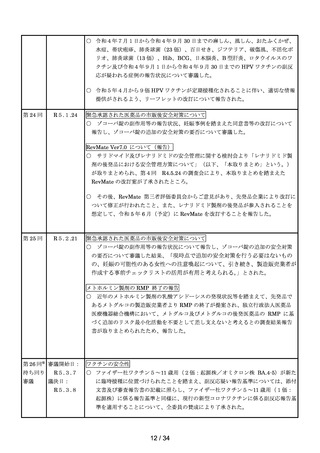
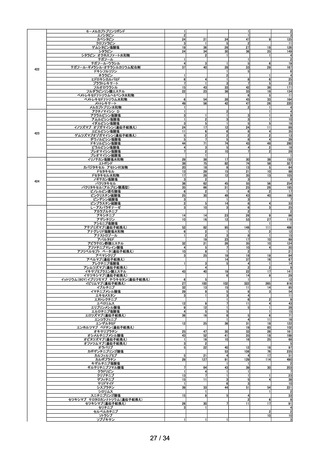
能障害の指標は eGFR で設定し、高度腎機能障害患者については、本臨床試験
における組入れ基準を踏まえ、eGFR が 30mL/min/1.73 m2 未満の患者とす
る)
シタグリプチンリン酸塩水和物製剤におけるニトロソアミン類の検出への対応につい
て
○ シタグリプチンリン酸塩水和物製剤からニトロソアミン類(NTTP)が検出されたこ
とを受け、令和4年9月1日付けで発出した事務連絡の内容について報告した。
アモキサピン製剤におけるニトロソアミン類の検出への対応について
○ アモキサピン製剤からニトロソアミン類(N-ニトロソアモキサピン)が検出され
たことを受け、令和4年9月1日付けで発出した事務連絡の内容について報告し
た。
第 14 回
R4.10.7
※
ワクチンの安全性
○ 新型コロナワクチンの副反応疑い報告状況について報告し、新型コロナワクチン接
種後のアナフィラキシー報告、死亡報告、血小板減少を伴う血栓症の報告、心筋
炎・心膜炎報告、性・年齢別解析等、安全性について審議した。
○ 新型コロナワクチン接種後の健康状況に係る調査について報告された。
○ 令和4年4月1日から令和4年6月 30 日までの麻しん、風しん、おたふくかぜ、
水痘、帯状疱疹、肺炎球菌(23 価)、百日せき、ジフテリア、破傷風、不活化ポリ
オ、肺炎球菌(13 価)、Hib、BCG、日本脳炎、B 型肝炎、ロタウイルスのワクチ
ンの副反応が疑われる症例の報告状況について審議した。
○ 令和4年8月1日から令和4年8月 31 日までの HPV ワクチンの副反応が疑われ
る症例の報告状況について審議した。また、令和4年4月からの積極的勧奨再開に
伴い、積極的勧奨再開直後の6か月間は頻度を上げて評価を行っていたが、令和4
年9月以降の報告状況については、従来の3か月に1回のスケジュールにて評価を
行うことについて審議し、了承された。
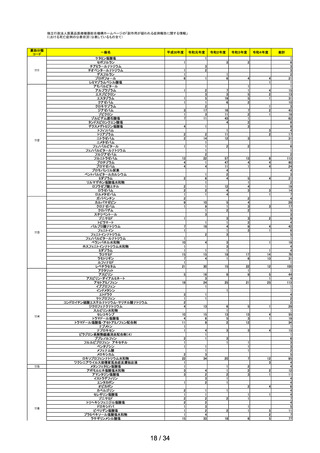
第 15 回※ 審議開始日:
持ち回り
審議
R4.10.11
議決日:
R4.10.20
ワクチンの安全性
○ ファイザー社ワクチン(2価:起源株/オミクロン株 BA.4-5)及びファイザー社
ワクチン6カ月~4歳用が新たに臨時接種に位置づけられ、これらの接種開始に伴
う副反応疑い報告基準の変更の要否について、委員の意見を踏まえつつ、審議を継
続することとされた。
第 16 回※
R4.10.21
ワクチンの安全性
○ ファイザー社ワクチン6カ月~4歳用の接種開始に伴い、新型コロナワクチンの副
反応報告基準を改正し、新たに症状として「熱性けいれん」を追加し、その報告期
間を「7日」とすること、また、ファイザー社ワクチン(2価:起源株/オミクロ
ン株 BA.4-5)接種開始に伴い、これまでと同様に、新型コロナワクチン感染症の
予防接種に適用される報告基準を適用することについて審議し、了承された。
9 / 34
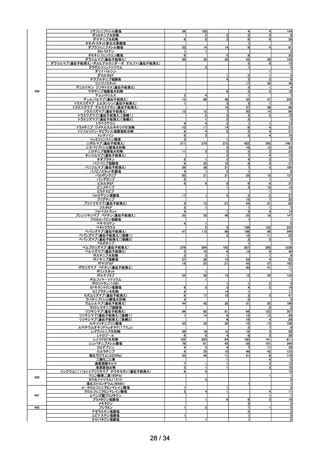
における組入れ基準を踏まえ、eGFR が 30mL/min/1.73 m2 未満の患者とす
る)
シタグリプチンリン酸塩水和物製剤におけるニトロソアミン類の検出への対応につい
て
○ シタグリプチンリン酸塩水和物製剤からニトロソアミン類(NTTP)が検出されたこ
とを受け、令和4年9月1日付けで発出した事務連絡の内容について報告した。
アモキサピン製剤におけるニトロソアミン類の検出への対応について
○ アモキサピン製剤からニトロソアミン類(N-ニトロソアモキサピン)が検出され
たことを受け、令和4年9月1日付けで発出した事務連絡の内容について報告し
た。
第 14 回
R4.10.7
※
ワクチンの安全性
○ 新型コロナワクチンの副反応疑い報告状況について報告し、新型コロナワクチン接
種後のアナフィラキシー報告、死亡報告、血小板減少を伴う血栓症の報告、心筋
炎・心膜炎報告、性・年齢別解析等、安全性について審議した。
○ 新型コロナワクチン接種後の健康状況に係る調査について報告された。
○ 令和4年4月1日から令和4年6月 30 日までの麻しん、風しん、おたふくかぜ、
水痘、帯状疱疹、肺炎球菌(23 価)、百日せき、ジフテリア、破傷風、不活化ポリ
オ、肺炎球菌(13 価)、Hib、BCG、日本脳炎、B 型肝炎、ロタウイルスのワクチ
ンの副反応が疑われる症例の報告状況について審議した。
○ 令和4年8月1日から令和4年8月 31 日までの HPV ワクチンの副反応が疑われ
る症例の報告状況について審議した。また、令和4年4月からの積極的勧奨再開に
伴い、積極的勧奨再開直後の6か月間は頻度を上げて評価を行っていたが、令和4
年9月以降の報告状況については、従来の3か月に1回のスケジュールにて評価を
行うことについて審議し、了承された。
第 15 回※ 審議開始日:
持ち回り
審議
R4.10.11
議決日:
R4.10.20
ワクチンの安全性
○ ファイザー社ワクチン(2価:起源株/オミクロン株 BA.4-5)及びファイザー社
ワクチン6カ月~4歳用が新たに臨時接種に位置づけられ、これらの接種開始に伴
う副反応疑い報告基準の変更の要否について、委員の意見を踏まえつつ、審議を継
続することとされた。
第 16 回※
R4.10.21
ワクチンの安全性
○ ファイザー社ワクチン6カ月~4歳用の接種開始に伴い、新型コロナワクチンの副
反応報告基準を改正し、新たに症状として「熱性けいれん」を追加し、その報告期
間を「7日」とすること、また、ファイザー社ワクチン(2価:起源株/オミクロ
ン株 BA.4-5)接種開始に伴い、これまでと同様に、新型コロナワクチン感染症の
予防接種に適用される報告基準を適用することについて審議し、了承された。
9 / 34