よむ、つかう、まなぶ。
資料2-1 令和4年度の安全対策について [774KB] (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_33888.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和5年度第1回 6/29)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
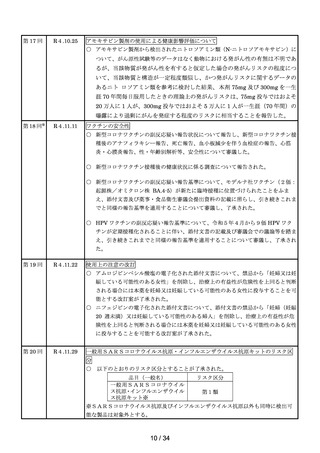
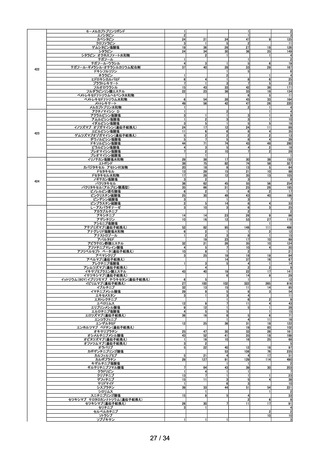
第 11 回
R4.9.2
※
ワクチンの安全性
○ 新型コロナワクチンの副反応疑い報告状況について報告し、新型コロナワクチン接
種後のアナフィラキシー報告、死亡報告、血小板減少を伴う血栓症の報告、心筋
炎・心膜炎報告、性・年齢別解析等、安全性について審議した。
○ 新型コロナワクチンの各ワクチンの電子化された添付文書を改訂し、ファイザー社
ワクチン、モデルナ社ワクチン、アストラゼネカ社ワクチン及び武田社ワクチン
(ノババックス)接種後の感覚鈍麻、錯感覚及びアストラゼネカ社ワクチン接種後
の耳鳴について「その他の副反応」への追記、モデルナ社ワクチン接種後に毛細血
管漏出症候群の再燃が報告されていることについて情報提供を実施した旨を報告し
た。
○ 新型コロナワクチン接種後の健康状況に係る調査について報告された。
○ 令和4年7月1日から令和4年7月 31 日までの HPV ワクチンの副反応が疑われ
る症例の報告状況について審議した。
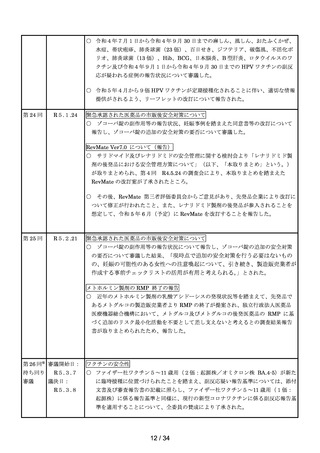
第 12 回
R4.9.14
※
ワクチンの安全性
○ 新型コロナワクチンの副反応疑い報告基準について、ファイザー社ワクチン(2
価:起源株/オミクロン株 BA.1)及びモデルナ社ワクチン(2価:起源株/オ
ミクロン株 BA.1)が新たに臨時接種に位置づけられたことを踏まえ、両ワクチ
ンの添付文書及び審査報告書の記載に照らし、引き続きこれまでと同様の報告基準
とすることについて審議し、了承された。
第 13 回
R4.9.27
要指導医薬品のリスク評価
○
製造販売後調査の結果を踏まえて、以下の要指導医薬品についてリスク評価を行
い、第1類医薬品とする案が了承された。
品目(一般名)
審議前
審議後
フルチカゾンプロピオン酸
エステル
要指導
第1類
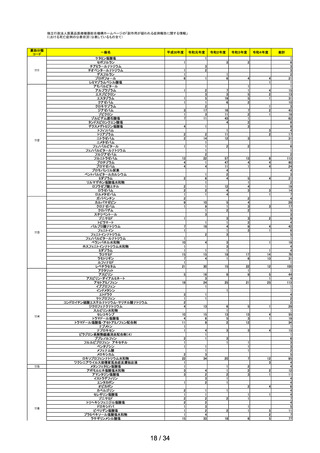
一般用医薬品のリスク区分
○
製造販売後調査の結果を踏まえて、以下の一般用医薬品についてリスク区分の検
討を行い、指定第2類医薬品とする案が了承された。
品目(一般名)
フルニソリド
審議前
審議後
第1類
指定第2類
使用上の注意の改訂
○ ペマフィブラートの電子化された添付文書について、「血清クレアチニン値が
2.5mg/dL 以上又はクレアチニンクリアランスが 40mL/min 未満の腎機能障害
のある患者」を「禁忌」の項から削除し、当該高度腎機能障害患者を「慎重投
与」に設定するとともに、
「用法・用量に関連する使用上の注意」において、同
対象について、最大用量は 1 日 0.2 mg までとする改訂案が了承された(腎機
8 / 34
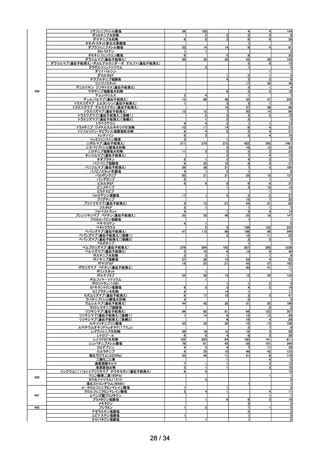
R4.9.2
※
ワクチンの安全性
○ 新型コロナワクチンの副反応疑い報告状況について報告し、新型コロナワクチン接
種後のアナフィラキシー報告、死亡報告、血小板減少を伴う血栓症の報告、心筋
炎・心膜炎報告、性・年齢別解析等、安全性について審議した。
○ 新型コロナワクチンの各ワクチンの電子化された添付文書を改訂し、ファイザー社
ワクチン、モデルナ社ワクチン、アストラゼネカ社ワクチン及び武田社ワクチン
(ノババックス)接種後の感覚鈍麻、錯感覚及びアストラゼネカ社ワクチン接種後
の耳鳴について「その他の副反応」への追記、モデルナ社ワクチン接種後に毛細血
管漏出症候群の再燃が報告されていることについて情報提供を実施した旨を報告し
た。
○ 新型コロナワクチン接種後の健康状況に係る調査について報告された。
○ 令和4年7月1日から令和4年7月 31 日までの HPV ワクチンの副反応が疑われ
る症例の報告状況について審議した。
第 12 回
R4.9.14
※
ワクチンの安全性
○ 新型コロナワクチンの副反応疑い報告基準について、ファイザー社ワクチン(2
価:起源株/オミクロン株 BA.1)及びモデルナ社ワクチン(2価:起源株/オ
ミクロン株 BA.1)が新たに臨時接種に位置づけられたことを踏まえ、両ワクチ
ンの添付文書及び審査報告書の記載に照らし、引き続きこれまでと同様の報告基準
とすることについて審議し、了承された。
第 13 回
R4.9.27
要指導医薬品のリスク評価
○
製造販売後調査の結果を踏まえて、以下の要指導医薬品についてリスク評価を行
い、第1類医薬品とする案が了承された。
品目(一般名)
審議前
審議後
フルチカゾンプロピオン酸
エステル
要指導
第1類
一般用医薬品のリスク区分
○
製造販売後調査の結果を踏まえて、以下の一般用医薬品についてリスク区分の検
討を行い、指定第2類医薬品とする案が了承された。
品目(一般名)
フルニソリド
審議前
審議後
第1類
指定第2類
使用上の注意の改訂
○ ペマフィブラートの電子化された添付文書について、「血清クレアチニン値が
2.5mg/dL 以上又はクレアチニンクリアランスが 40mL/min 未満の腎機能障害
のある患者」を「禁忌」の項から削除し、当該高度腎機能障害患者を「慎重投
与」に設定するとともに、
「用法・用量に関連する使用上の注意」において、同
対象について、最大用量は 1 日 0.2 mg までとする改訂案が了承された(腎機
8 / 34