よむ、つかう、まなぶ。
資料2-1 令和4年度の安全対策について [774KB] (13 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_33888.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和5年度第1回 6/29)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
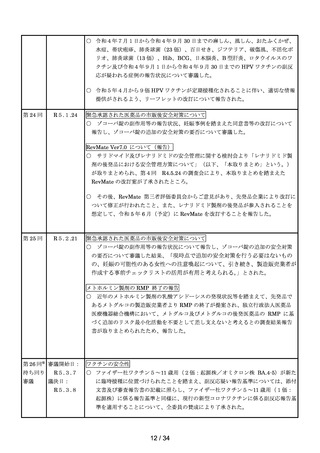
○ 令和4年7月1日から令和4年9月 30 日までの麻しん、風しん、おたふくかぜ、
水痘、帯状疱疹、肺炎球菌(23 価)、百日せき、ジフテリア、破傷風、不活化ポ
リオ、肺炎球菌(13 価)、Hib、BCG、日本脳炎、B 型肝炎、ロタウイルスのワ
クチン及び令和4年9月1日から令和4年9月 30 日までの HPV ワクチンの副反
応が疑われる症例の報告状況について審議した。
○ 令和5年4月から9価 HPV ワクチンが定期接種化されることに伴い、適切な情報
提供がされるよう、リーフレットの改訂について報告された。
第 24 回
R5.1.24
緊急承認された医薬品の市販後安全対策について
○
ゾコーバ錠の副作用等の報告状況、妊娠事例を踏まえた同意書等の改訂について
報告し、ゾコーバ錠の追加の安全対策の要否について審議した。
RevMate Ver7.0 について(報告)
○
サリドマイド及びレナリドミドの安全管理に関する検討会より「レナリドミド製
剤の後発品における安全管理方策について」(以下、「本取りまとめ」という。)
が取りまとめられ、第4回
R4.5.24 の調査会により、本取りまとめを踏まえた
RevMate の改訂案が了承されたところ。
○
その後、RevMate 第三者評価委員会からご意見があり、先発品企業により改訂に
ついて修正が行われたこと、また、レナリドミド製剤の後発品が参入されることを
想定して、令和 5 年 6 月(予定)に RevMate を改訂することを報告した。
第 25 回
R5.2.21
緊急承認された医薬品の市販後安全対策について
○
ゾコーバ錠の副作用等の報告状況について報告し、ゾコーバ錠の追加の安全対策
の要否について審議した結果、「現時点で追加の安全対策を行う必要はないもの
の、妊娠の可能性のある女性への注意喚起について、引き続き、製造販売業者が
作成する事前チェックリストの活用が有用と考えられる。」とされた。
メトホルミン製剤の RMP 終了の報告
○
近年のメトホルミン製剤の乳酸アシドーシスの発現状況等を踏まえて、先発品で
あるメトグルコの製造販売業者より RMP の終了が提案され、独立行政法人医薬品
医療機器総合機構において、メトグルコ及びメトグルコの後発医薬品の RMP に基
づく追加のリスク最小化活動を不要として差し支えないと考えるとの調査結果報告
書が取りまとめられたため、報告した。
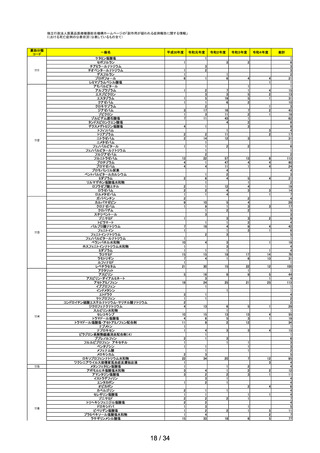
第 26 回※ 審議開始日:
持ち回り
審議
R5.3.7
議決日:
R5.3.8
ワクチンの安全性
○ ファイザー社ワクチン5~11 歳用(2価:起源株/オミクロン株 BA.4-5)が新た
に臨時接種に位置づけられたことを踏まえ、副反応疑い報告基準については、添付
文書及び審査報告書の記載に照らし、ファイザー社ワクチン5~11 歳用(1価:
起源株)に係る報告基準と同様に、現行の新型コロナワクチンに係る副反応報告基
準を適用することについて、全委員の賛成により了承された。
12 / 34
水痘、帯状疱疹、肺炎球菌(23 価)、百日せき、ジフテリア、破傷風、不活化ポ
リオ、肺炎球菌(13 価)、Hib、BCG、日本脳炎、B 型肝炎、ロタウイルスのワ
クチン及び令和4年9月1日から令和4年9月 30 日までの HPV ワクチンの副反
応が疑われる症例の報告状況について審議した。
○ 令和5年4月から9価 HPV ワクチンが定期接種化されることに伴い、適切な情報
提供がされるよう、リーフレットの改訂について報告された。
第 24 回
R5.1.24
緊急承認された医薬品の市販後安全対策について
○
ゾコーバ錠の副作用等の報告状況、妊娠事例を踏まえた同意書等の改訂について
報告し、ゾコーバ錠の追加の安全対策の要否について審議した。
RevMate Ver7.0 について(報告)
○
サリドマイド及びレナリドミドの安全管理に関する検討会より「レナリドミド製
剤の後発品における安全管理方策について」(以下、「本取りまとめ」という。)
が取りまとめられ、第4回
R4.5.24 の調査会により、本取りまとめを踏まえた
RevMate の改訂案が了承されたところ。
○
その後、RevMate 第三者評価委員会からご意見があり、先発品企業により改訂に
ついて修正が行われたこと、また、レナリドミド製剤の後発品が参入されることを
想定して、令和 5 年 6 月(予定)に RevMate を改訂することを報告した。
第 25 回
R5.2.21
緊急承認された医薬品の市販後安全対策について
○
ゾコーバ錠の副作用等の報告状況について報告し、ゾコーバ錠の追加の安全対策
の要否について審議した結果、「現時点で追加の安全対策を行う必要はないもの
の、妊娠の可能性のある女性への注意喚起について、引き続き、製造販売業者が
作成する事前チェックリストの活用が有用と考えられる。」とされた。
メトホルミン製剤の RMP 終了の報告
○
近年のメトホルミン製剤の乳酸アシドーシスの発現状況等を踏まえて、先発品で
あるメトグルコの製造販売業者より RMP の終了が提案され、独立行政法人医薬品
医療機器総合機構において、メトグルコ及びメトグルコの後発医薬品の RMP に基
づく追加のリスク最小化活動を不要として差し支えないと考えるとの調査結果報告
書が取りまとめられたため、報告した。
第 26 回※ 審議開始日:
持ち回り
審議
R5.3.7
議決日:
R5.3.8
ワクチンの安全性
○ ファイザー社ワクチン5~11 歳用(2価:起源株/オミクロン株 BA.4-5)が新た
に臨時接種に位置づけられたことを踏まえ、副反応疑い報告基準については、添付
文書及び審査報告書の記載に照らし、ファイザー社ワクチン5~11 歳用(1価:
起源株)に係る報告基準と同様に、現行の新型コロナワクチンに係る副反応報告基
準を適用することについて、全委員の賛成により了承された。
12 / 34