よむ、つかう、まなぶ。
資料2-1 令和4年度の安全対策について [774KB] (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_33888.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和5年度第1回 6/29)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
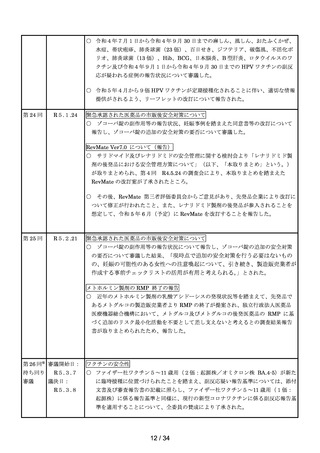
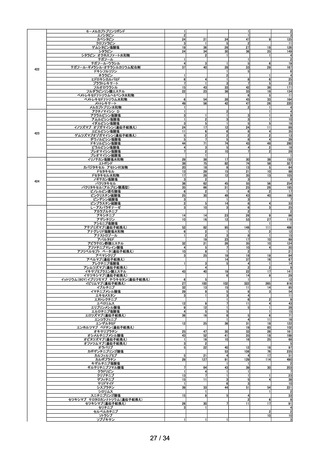
第 17 回
R4.10.25
アモキサピン製剤の使用による健康影響評価について
○ アモキサピン製剤から検出されたニトロソアミン類(N-ニトロソアモキサピン)に
ついて、がん原性試験等のデータはなく動物における発がん性の有無は不明であ
るが、当該物質が発がん性を有すると仮定した場合の発がんリスクの程度につ
いて、当該物質と構造が一定程度類似し、かつ発がんリスクに関するデータの
あるニト ロソアミン類を参考に検討した結果、 本剤 75mg 及び 300mg を一生
涯 70 年間毎日服用したときの理論上の発がんリスクは、75mg 投与ではおよそ
20 万人に 1 人が、300mg 投与ではおよそ 5 万人に 1 人が一生涯(70 年間)の
曝露により過剰にがんを発症する程度のリスクに相当することを報告した。
第 18 回※
R4.11.11
ワクチンの安全性
○ 新型コロナワクチンの副反応疑い報告状況について報告し、新型コロナワクチン接
種後のアナフィラキシー報告、死亡報告、血小板減少を伴う血栓症の報告、心筋
炎・心膜炎報告、性・年齢別解析等、安全性について審議した。
○ 新型コロナワクチン接種後の健康状況に係る調査について報告された。
○ 新型コロナワクチンの副反応疑い報告基準について、モデルナ社ワクチン(2価:
起源株/オミクロン株 BA.4-5)が新たに臨時接種に位置づけられたことをふま
え、添付文書及び薬事・食品衛生審議会提出資料の記載に照らし、引き続きこれま
でと同様の報告基準を適用することについて審議し、了承された。
○ HPV ワクチンの副反応疑い報告基準について、令和5年4月から9価 HPV ワク
チンが定期接種化されることに伴い、添付文書の記載及び審議会での議論等を踏ま
え、引き続きこれまでと同様の報告基準を適用することについて審議し、了承され
た。
第 19 回
R4.11.22
使用上の注意の改訂
○ アムロジピンベシル酸塩の電子化された添付文書について、禁忌から「妊婦又は妊
娠している可能性のある女性」を削除し、治療上の有益性が危険性を上回ると判断
される場合には本薬を妊婦又は妊娠している可能性のある女性に投与することを可
能とする改訂案が了承された。
○ ニフェジピンの電子化された添付文書について、添付文書の禁忌から「妊婦(妊娠
20 週未満)又は妊娠している可能性のある婦人」を削除し、治療上の有益性が危
険性を上回ると判断される場合には本薬を妊婦又は妊娠している可能性のある女性
に投与することを可能する改訂案が了承された。
第 20 回
R4.11.29
一般用SARSコロナウイルス抗原・インフルエンザウイルス抗原キットのリスク区
分
○
以下のとおりのリスク区分とすることが了承された。
品目(一般名)
一般用SARSコロナウイル
ス抗原・インフルエンザウイル
ス抗原キット※
リスク区分
第1類
※SARSコロナウイルス抗原及びインフルエンザウイルス抗原以外も同時に検出可
能な製品は対象外とする。
10 / 34
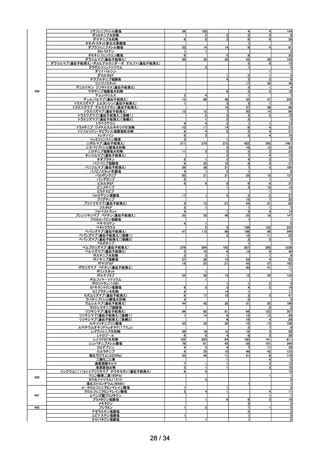
R4.10.25
アモキサピン製剤の使用による健康影響評価について
○ アモキサピン製剤から検出されたニトロソアミン類(N-ニトロソアモキサピン)に
ついて、がん原性試験等のデータはなく動物における発がん性の有無は不明であ
るが、当該物質が発がん性を有すると仮定した場合の発がんリスクの程度につ
いて、当該物質と構造が一定程度類似し、かつ発がんリスクに関するデータの
あるニト ロソアミン類を参考に検討した結果、 本剤 75mg 及び 300mg を一生
涯 70 年間毎日服用したときの理論上の発がんリスクは、75mg 投与ではおよそ
20 万人に 1 人が、300mg 投与ではおよそ 5 万人に 1 人が一生涯(70 年間)の
曝露により過剰にがんを発症する程度のリスクに相当することを報告した。
第 18 回※
R4.11.11
ワクチンの安全性
○ 新型コロナワクチンの副反応疑い報告状況について報告し、新型コロナワクチン接
種後のアナフィラキシー報告、死亡報告、血小板減少を伴う血栓症の報告、心筋
炎・心膜炎報告、性・年齢別解析等、安全性について審議した。
○ 新型コロナワクチン接種後の健康状況に係る調査について報告された。
○ 新型コロナワクチンの副反応疑い報告基準について、モデルナ社ワクチン(2価:
起源株/オミクロン株 BA.4-5)が新たに臨時接種に位置づけられたことをふま
え、添付文書及び薬事・食品衛生審議会提出資料の記載に照らし、引き続きこれま
でと同様の報告基準を適用することについて審議し、了承された。
○ HPV ワクチンの副反応疑い報告基準について、令和5年4月から9価 HPV ワク
チンが定期接種化されることに伴い、添付文書の記載及び審議会での議論等を踏ま
え、引き続きこれまでと同様の報告基準を適用することについて審議し、了承され
た。
第 19 回
R4.11.22
使用上の注意の改訂
○ アムロジピンベシル酸塩の電子化された添付文書について、禁忌から「妊婦又は妊
娠している可能性のある女性」を削除し、治療上の有益性が危険性を上回ると判断
される場合には本薬を妊婦又は妊娠している可能性のある女性に投与することを可
能とする改訂案が了承された。
○ ニフェジピンの電子化された添付文書について、添付文書の禁忌から「妊婦(妊娠
20 週未満)又は妊娠している可能性のある婦人」を削除し、治療上の有益性が危
険性を上回ると判断される場合には本薬を妊婦又は妊娠している可能性のある女性
に投与することを可能する改訂案が了承された。
第 20 回
R4.11.29
一般用SARSコロナウイルス抗原・インフルエンザウイルス抗原キットのリスク区
分
○
以下のとおりのリスク区分とすることが了承された。
品目(一般名)
一般用SARSコロナウイル
ス抗原・インフルエンザウイル
ス抗原キット※
リスク区分
第1類
※SARSコロナウイルス抗原及びインフルエンザウイルス抗原以外も同時に検出可
能な製品は対象外とする。
10 / 34