よむ、つかう、まなぶ。
資料2-1 令和4年度の安全対策について [774KB] (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_33888.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和5年度第1回 6/29)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
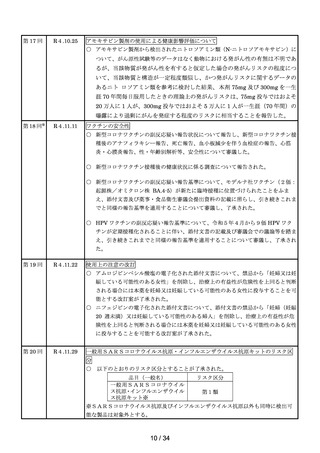
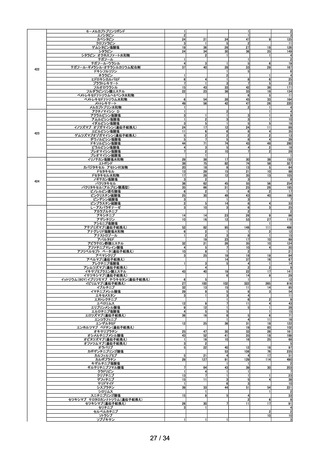
令和4年度の安全対策について(概要)
1.過去5年間(平成 30 年度~令和4年度)の副作用等の報告数の推移
(1)医薬品(医療用医薬品、要指導医薬品、一般用医薬品の合算)
医薬関係者
からの副作
外国措置報告 感染症定期報告 用報告※3
(単位:例
)
1,451
1,084
9,931
1,579
1,061
9,537
製造販売業者からの報告(単位:件)※1
年度
副作用報告※2 感染症報告※2
研究報告
平成30
令和元
62,037
60,405
73
72
1,078
983
令和2
令和3
51,359
82,257
70
51
874
989
1,652
1,730
1,070
1,060
10,985
40,374
令和4
71,176
55
1,024
1,611
1,064
11,819
※1
報告受付後、受理した製造販売業者から取り下げ報告(報告後に医薬品を服用していなかったことなどが判明したもの
等)、対象外報告(報告後に追加情報により、因果関係が否定されたもの等)された報告も数に含む。
※2
国内症例の報告。
※3
安全性情報報告制度に基づく副作用報告件数と予防接種後副反応疑い報告件数の合計。
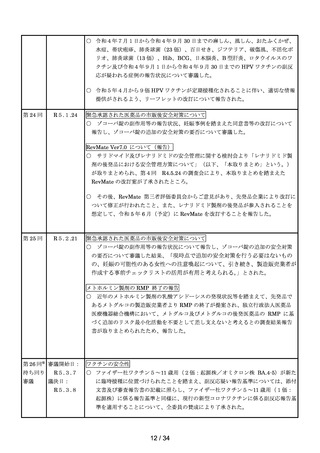
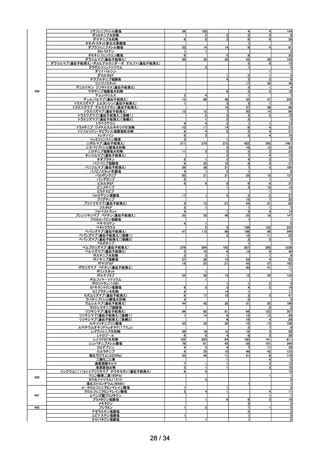
(2)コンビネーション医薬品※4(製造販売業者からの報告)
年度
平成 30
令和元
令和2
令和3
令和4
1,653
1,395
1,429
1,480
1,894
2,542
2,634
2,622
2,929
3,069
コンビネーション医
薬品の不具合症例
(国内)
コンビネーション医
薬品の不具合症例
(外国)
※4
医薬品たるコンビネーション製品とはインスリンペン注等、機械器具等と一体的に販売するものとして承認を受けた
医薬品をいい、平成 26 年 11 月 25 日の医薬品医療機器法施行後、平成 26 年 11 月 25 日から平成 28 年 11 月 24 日まで
の経過措置期間の後、平成 28 年 11 月 25 日から報告が義務化された。
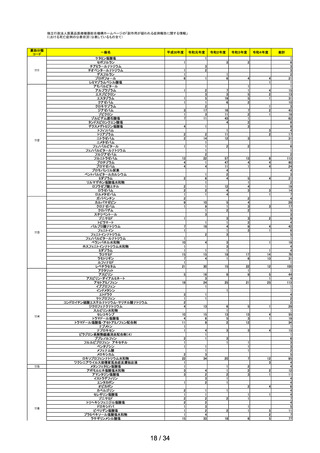
(3)医薬部外品/化粧品※5(製造販売業者からの報告)
※5
年度
平成 30
令和元
令和2
令和3
令和4
医薬部外品(国内)
103
119
97
78
104
化粧品(国内)
83
80
58
63
142
平成 26 年4月1日の薬事法施行規則及び医薬品、医薬部外品、化粧品及び
医療機器の製造販売後安全管理の基準に関する省令の一部を改正する省令施行後の報告が義務化された。
1 / 34
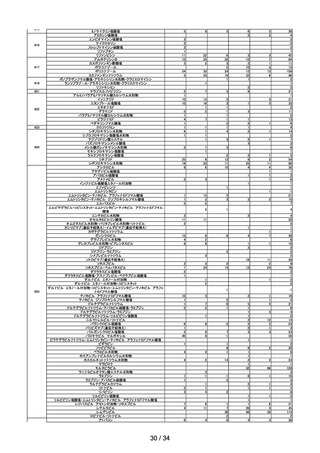
1.過去5年間(平成 30 年度~令和4年度)の副作用等の報告数の推移
(1)医薬品(医療用医薬品、要指導医薬品、一般用医薬品の合算)
医薬関係者
からの副作
外国措置報告 感染症定期報告 用報告※3
(単位:例
)
1,451
1,084
9,931
1,579
1,061
9,537
製造販売業者からの報告(単位:件)※1
年度
副作用報告※2 感染症報告※2
研究報告
平成30
令和元
62,037
60,405
73
72
1,078
983
令和2
令和3
51,359
82,257
70
51
874
989
1,652
1,730
1,070
1,060
10,985
40,374
令和4
71,176
55
1,024
1,611
1,064
11,819
※1
報告受付後、受理した製造販売業者から取り下げ報告(報告後に医薬品を服用していなかったことなどが判明したもの
等)、対象外報告(報告後に追加情報により、因果関係が否定されたもの等)された報告も数に含む。
※2
国内症例の報告。
※3
安全性情報報告制度に基づく副作用報告件数と予防接種後副反応疑い報告件数の合計。
(2)コンビネーション医薬品※4(製造販売業者からの報告)
年度
平成 30
令和元
令和2
令和3
令和4
1,653
1,395
1,429
1,480
1,894
2,542
2,634
2,622
2,929
3,069
コンビネーション医
薬品の不具合症例
(国内)
コンビネーション医
薬品の不具合症例
(外国)
※4
医薬品たるコンビネーション製品とはインスリンペン注等、機械器具等と一体的に販売するものとして承認を受けた
医薬品をいい、平成 26 年 11 月 25 日の医薬品医療機器法施行後、平成 26 年 11 月 25 日から平成 28 年 11 月 24 日まで
の経過措置期間の後、平成 28 年 11 月 25 日から報告が義務化された。
(3)医薬部外品/化粧品※5(製造販売業者からの報告)
※5
年度
平成 30
令和元
令和2
令和3
令和4
医薬部外品(国内)
103
119
97
78
104
化粧品(国内)
83
80
58
63
142
平成 26 年4月1日の薬事法施行規則及び医薬品、医薬部外品、化粧品及び
医療機器の製造販売後安全管理の基準に関する省令の一部を改正する省令施行後の報告が義務化された。
1 / 34