よむ、つかう、まなぶ。
資料2-1 令和4年度の安全対策について [774KB] (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_33888.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和5年度第1回 6/29)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
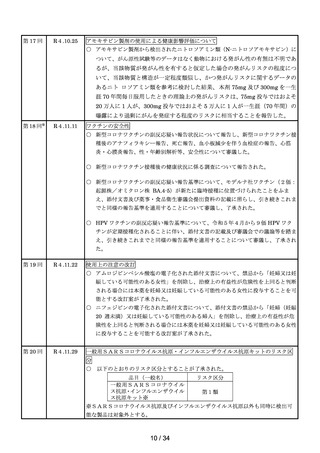
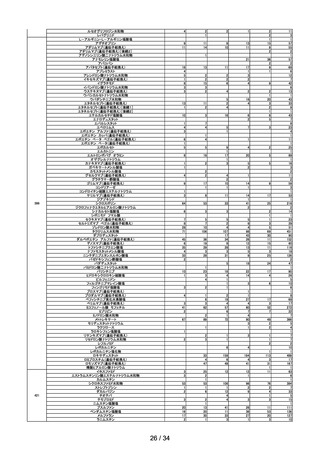
(2)安全対策調査会
回数
開催日
第1回※
R4.4.13
開催結果概要
ワクチンの安全性
○ 新型コロナワクチンの副反応疑い報告状況について報告し、新型コロナワクチン接
種後のアナフィラキシー報告、死亡報告、血小板減少を伴う血栓症の報告、心筋
炎・心膜炎報告、性・年齢別解析等、安全性について審議した。
○ 新型コロナワクチン接種後の健康状況に係る調査について報告された。
○ 令和3年 10 月1日から令和3年 12 月 31 日までの麻しん、風しん、おたふくか
ぜ、水痘、帯状疱疹、肺炎球菌(23 価)、HPV、百日せき、ジフテリア、破傷
風、不活化ポリオ、肺炎球菌(13 価)、Hib、BCG、日本脳炎、B 型肝炎、ロタウ
イルス、インフルエンザのワクチンの副反応が疑われる症例の報告状況について審
議した。
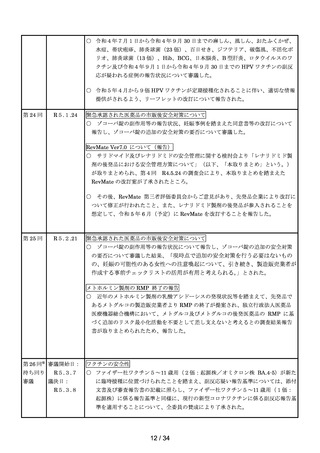
第2回
R4.4.26
一般用医薬品のリスク区分
○
製造販売後調査の結果を踏まえて、以下の一般用医薬品についてリスク区分の検
討を行い、第1類医薬品とする案が了承された。
品目(一般名)
クロトリマゾール
第3回※
R4.5.13
審議前
審議後
第1類
第1類
ワクチンの安全性
○ 武田社ワクチン(ノババックス)が新たに臨時接種に位置づけられたことを踏ま
え、武田社ワクチン(ノババックス)の副反応疑い報告基準について、現時点にお
いて臨時接種の対象となっている全ての新型コロナワクチンと同一の報告基準とす
ることについて審議し、了承された。
○ 新型コロナワクチンの副反応疑い報告状況について報告し、新型コロナワクチン接
種後のアナフィラキシー報告、死亡報告、血小板減少を伴う血栓症の報告、心筋
炎・心膜炎報告、性・年齢別解析等、安全性について審議した。
○ 新型コロナワクチン接種後の健康状況に係る調査について報告された。
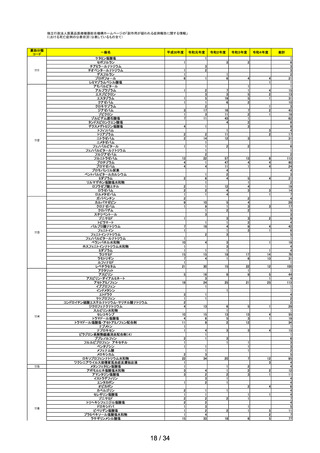
第4回
R4.5.24
レナリドミド製剤の後発品における安全管理方策について
○
多発性骨髄腫等の治療薬であるレナリドミド製剤は、催奇形性を有する薬剤であ
ることから、 胎児への薬剤曝露防止を目的とした厳格な管理手順(レブラミド・
ポマリスト適正管理手順 (以下、「RevMate」という))の実施が義務づけられ
ている。
○
サリドマイド及びレナリドミドの安全管理に関する検討会より「レナリドミド製
剤の後発品における安全管理方策について」(以下、「本取りまとめ」とい
う。)が取りまとめられた。
○
本取りまとめと本取りまとめを踏まえた RevMate の改訂案について本調査会で審
議され、了承された。
5 / 34
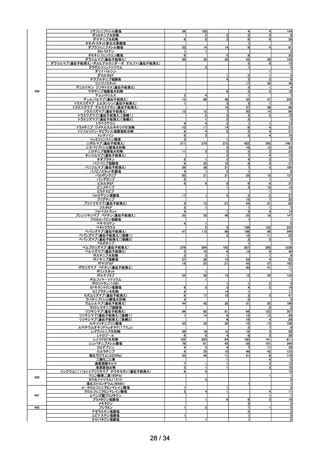
回数
開催日
第1回※
R4.4.13
開催結果概要
ワクチンの安全性
○ 新型コロナワクチンの副反応疑い報告状況について報告し、新型コロナワクチン接
種後のアナフィラキシー報告、死亡報告、血小板減少を伴う血栓症の報告、心筋
炎・心膜炎報告、性・年齢別解析等、安全性について審議した。
○ 新型コロナワクチン接種後の健康状況に係る調査について報告された。
○ 令和3年 10 月1日から令和3年 12 月 31 日までの麻しん、風しん、おたふくか
ぜ、水痘、帯状疱疹、肺炎球菌(23 価)、HPV、百日せき、ジフテリア、破傷
風、不活化ポリオ、肺炎球菌(13 価)、Hib、BCG、日本脳炎、B 型肝炎、ロタウ
イルス、インフルエンザのワクチンの副反応が疑われる症例の報告状況について審
議した。
第2回
R4.4.26
一般用医薬品のリスク区分
○
製造販売後調査の結果を踏まえて、以下の一般用医薬品についてリスク区分の検
討を行い、第1類医薬品とする案が了承された。
品目(一般名)
クロトリマゾール
第3回※
R4.5.13
審議前
審議後
第1類
第1類
ワクチンの安全性
○ 武田社ワクチン(ノババックス)が新たに臨時接種に位置づけられたことを踏ま
え、武田社ワクチン(ノババックス)の副反応疑い報告基準について、現時点にお
いて臨時接種の対象となっている全ての新型コロナワクチンと同一の報告基準とす
ることについて審議し、了承された。
○ 新型コロナワクチンの副反応疑い報告状況について報告し、新型コロナワクチン接
種後のアナフィラキシー報告、死亡報告、血小板減少を伴う血栓症の報告、心筋
炎・心膜炎報告、性・年齢別解析等、安全性について審議した。
○ 新型コロナワクチン接種後の健康状況に係る調査について報告された。
第4回
R4.5.24
レナリドミド製剤の後発品における安全管理方策について
○
多発性骨髄腫等の治療薬であるレナリドミド製剤は、催奇形性を有する薬剤であ
ることから、 胎児への薬剤曝露防止を目的とした厳格な管理手順(レブラミド・
ポマリスト適正管理手順 (以下、「RevMate」という))の実施が義務づけられ
ている。
○
サリドマイド及びレナリドミドの安全管理に関する検討会より「レナリドミド製
剤の後発品における安全管理方策について」(以下、「本取りまとめ」とい
う。)が取りまとめられた。
○
本取りまとめと本取りまとめを踏まえた RevMate の改訂案について本調査会で審
議され、了承された。
5 / 34