よむ、つかう、まなぶ。
資料2-2 医薬品等の使用上の注意の改訂について [469KB] (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_33888.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和5年度第1回 6/29)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
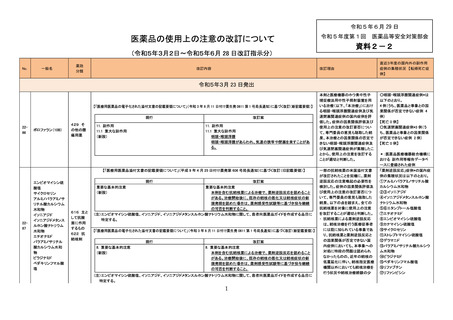
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく改訂(新記載要領)】
現行
8. 重要な基本的注意
〈肺結核及びその他の結核症〉
(新設)
改訂案
8. 重要な基本的注意
〈肺結核及びその他の結核症〉
本剤を含む抗結核薬による治療で、薬剤逆説反応を認めること
がある。治療開始後に、既存の結核の悪化又は結核症状の新
規発現を認めた場合は、薬剤感受性試験等に基づき投与継続
の可否を判断すること。
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく改訂(新記載要領)】
現行
2291
デラマニド
622 抗
結核剤
8. 重要な基本的注意
(新設)
改訂案
8. 重要な基本的注意
本剤を含む抗結核薬による治療で、薬剤逆説反応を認めること
がある。治療開始後に、既存の結核の悪化又は結核症状の新
規発現を認めた場合は、薬剤感受性試験等に基づき投与継続
の可否を判断すること。
令和5年3月 27 日発出
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく改訂(新記載要領)】
現行
2292
抗ヒト胸腺細胞ウサ
ギ免疫グロブリン
2301
アジルサルタン
アジルサルタン・ア
ムロジピンベシル酸
塩
アラセプリル
アリスキレンフマル
酸塩
イミダプリル塩酸塩
639 その
他の生物
学的製剤
改訂案
7. 用法及び用量に関連する注意
7. 用法及び用量に関連する注意
〈効能共通〉
〈効能共通〉
本剤又は他のウサギ血清製剤の投与歴のある患者に本剤をや
本剤又は他のウサギ血清製剤の投与歴のある患者には、他種
むを得ず再投与する際には、投与に先立って、本剤に対する抗
由来の抗ヒト胸腺細胞免疫グロブリン製剤の投与も考慮した上
体の有無を確認する等、必要な処置を講じた上で、医師の十分
で、本剤をやむを得ず再投与する際には、投与に先立って、本
な観察のもと投与すること。
剤に対する抗体の有無の確認や救急処置対策等、必要な処置
を講じた上で、医師の十分な観察のもと慎重に投与すること。
令和4年度第8回薬事・食品衛生
審議会医薬品第一部会(令和5年
3月3日開催)における議論結果等
を踏まえ、医薬品の「使用上の注
意」の改訂が必要と考えた。
-
妊娠中の調査対象医薬品の曝露
による児への影響が疑われる症例
(児の副作用関連症例)の集積状
況を評価した。妊娠中の調査対象
医薬品の曝露による児の副作用
関連症例が複数例報告されてお
り、その中には妊娠したことが把握
されず対象医薬品の曝露に至った
妊娠中の曝露による児の副作
用関連症例*の国内症例の集積
状況†は以下のとおり。
令和5年5月9日発出
【「医療用医薬品添付文書の記載要領について」(平成 9 年 4 月 25 日付け薬発第 606 号局長通知)に基づく改訂(旧記載要領)】
214 血
圧降下剤
217 血
管拡張剤
現行
妊婦、産婦、授乳婦等への投与
(新設)
改訂案
妊婦、産婦、授乳婦等への投与
妊娠する可能性のある女性に投与する場合には、本剤の投与
に 先立ち、代替薬の有無等も考慮して本剤投与の必要性を慎
重に検討し、治療上の有益性が危険性を上回ると判断される場
3
アンジオテンシン変換酵素阻害
剤 1 例【死亡 0 例】
1 アラセプリル 0 例
2 イミダプリル塩酸塩 0 例
現行
8. 重要な基本的注意
〈肺結核及びその他の結核症〉
(新設)
改訂案
8. 重要な基本的注意
〈肺結核及びその他の結核症〉
本剤を含む抗結核薬による治療で、薬剤逆説反応を認めること
がある。治療開始後に、既存の結核の悪化又は結核症状の新
規発現を認めた場合は、薬剤感受性試験等に基づき投与継続
の可否を判断すること。
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく改訂(新記載要領)】
現行
2291
デラマニド
622 抗
結核剤
8. 重要な基本的注意
(新設)
改訂案
8. 重要な基本的注意
本剤を含む抗結核薬による治療で、薬剤逆説反応を認めること
がある。治療開始後に、既存の結核の悪化又は結核症状の新
規発現を認めた場合は、薬剤感受性試験等に基づき投与継続
の可否を判断すること。
令和5年3月 27 日発出
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく改訂(新記載要領)】
現行
2292
抗ヒト胸腺細胞ウサ
ギ免疫グロブリン
2301
アジルサルタン
アジルサルタン・ア
ムロジピンベシル酸
塩
アラセプリル
アリスキレンフマル
酸塩
イミダプリル塩酸塩
639 その
他の生物
学的製剤
改訂案
7. 用法及び用量に関連する注意
7. 用法及び用量に関連する注意
〈効能共通〉
〈効能共通〉
本剤又は他のウサギ血清製剤の投与歴のある患者に本剤をや
本剤又は他のウサギ血清製剤の投与歴のある患者には、他種
むを得ず再投与する際には、投与に先立って、本剤に対する抗
由来の抗ヒト胸腺細胞免疫グロブリン製剤の投与も考慮した上
体の有無を確認する等、必要な処置を講じた上で、医師の十分
で、本剤をやむを得ず再投与する際には、投与に先立って、本
な観察のもと投与すること。
剤に対する抗体の有無の確認や救急処置対策等、必要な処置
を講じた上で、医師の十分な観察のもと慎重に投与すること。
令和4年度第8回薬事・食品衛生
審議会医薬品第一部会(令和5年
3月3日開催)における議論結果等
を踏まえ、医薬品の「使用上の注
意」の改訂が必要と考えた。
-
妊娠中の調査対象医薬品の曝露
による児への影響が疑われる症例
(児の副作用関連症例)の集積状
況を評価した。妊娠中の調査対象
医薬品の曝露による児の副作用
関連症例が複数例報告されてお
り、その中には妊娠したことが把握
されず対象医薬品の曝露に至った
妊娠中の曝露による児の副作
用関連症例*の国内症例の集積
状況†は以下のとおり。
令和5年5月9日発出
【「医療用医薬品添付文書の記載要領について」(平成 9 年 4 月 25 日付け薬発第 606 号局長通知)に基づく改訂(旧記載要領)】
214 血
圧降下剤
217 血
管拡張剤
現行
妊婦、産婦、授乳婦等への投与
(新設)
改訂案
妊婦、産婦、授乳婦等への投与
妊娠する可能性のある女性に投与する場合には、本剤の投与
に 先立ち、代替薬の有無等も考慮して本剤投与の必要性を慎
重に検討し、治療上の有益性が危険性を上回ると判断される場
3
アンジオテンシン変換酵素阻害
剤 1 例【死亡 0 例】
1 アラセプリル 0 例
2 イミダプリル塩酸塩 0 例