よむ、つかう、まなぶ。
資料3-3 カルボプラチン (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00031.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第57回 ) |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
資料 3‐3
医療上の必要性の高い未承認薬・適応外薬検討会議
公知申請への該当性に係る報告書(案)
カルボプラチン
子宮体癌
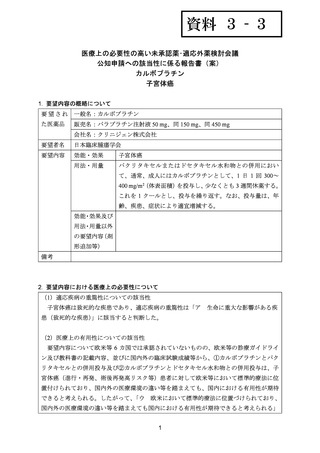
1. 要望内容の概略について
要 望 さ れ 一般名:カルボプラチン
た医薬品
販売名:パラプラチン注射液 50 mg、同 150 mg、同 450 mg
会社名:クリニジェン株式会社
要望者名
日本臨床腫瘍学会
要望内容
効能・効果
子宮体癌
用法・用量
パクリタキセルまたはドセタキセル水和物との併用におい
て、通常、成人にはカルボプラチンとして、1 日 1 回 300~
400 mg/m2(体表面積)を投与し、少なくとも 3 週間休薬する。
これを 1 クールとし、投与を繰り返す。なお、投与量は、年
齢、疾患、症状により適宜増減する。
効能・効果及び
用法・用量以外
の要望内容(剤
形追加等)
備考
2. 要望内容における医療上の必要性について
(1)適応疾病の重篤性についての該当性
子宮体癌は致死的な疾患であり、適応疾病の重篤性は「ア 生命に重大な影響がある疾
患(致死的な疾患)」に該当すると判断した。
(2)医療上の有用性についての該当性
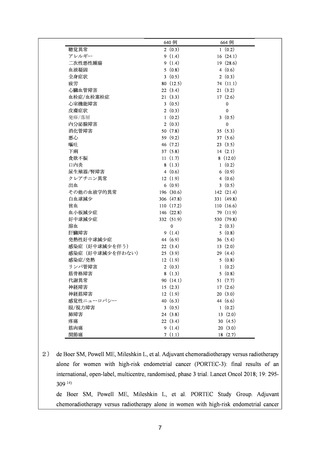
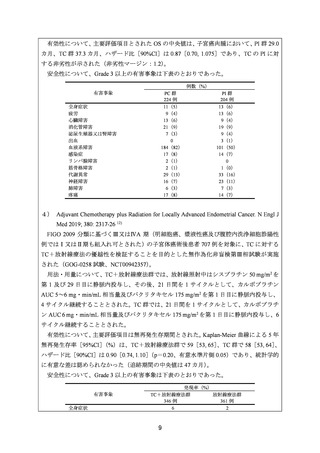
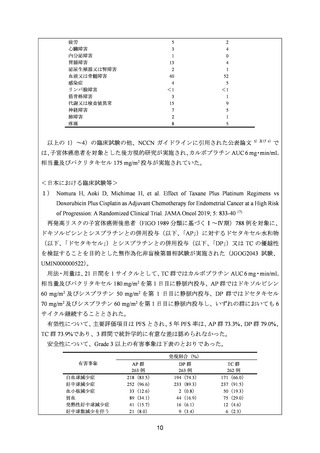
要望内容について欧米等 6 カ国では承認されていないものの、欧米等の診療ガイドライ
ン及び教科書の記載内容、並びに国内外の臨床試験成績等から、①カルボプラチンとパク
リタキセルとの併用投与及び②カルボプラチンとドセタキセル水和物との併用投与は、子
宮体癌(進行・再発、術後再発高リスク等)患者に対して欧米等において標準的療法に位
置付けられており、国内外の医療環境の違い等を踏まえても、国内における有用性が期待
できると考えられる。したがって、
「ウ 欧米において標準的療法に位置づけられており、
国内外の医療環境の違い等を踏まえても国内における有用性が期待できると考えられる」
1
医療上の必要性の高い未承認薬・適応外薬検討会議
公知申請への該当性に係る報告書(案)
カルボプラチン
子宮体癌
1. 要望内容の概略について
要 望 さ れ 一般名:カルボプラチン
た医薬品
販売名:パラプラチン注射液 50 mg、同 150 mg、同 450 mg
会社名:クリニジェン株式会社
要望者名
日本臨床腫瘍学会
要望内容
効能・効果
子宮体癌
用法・用量
パクリタキセルまたはドセタキセル水和物との併用におい
て、通常、成人にはカルボプラチンとして、1 日 1 回 300~
400 mg/m2(体表面積)を投与し、少なくとも 3 週間休薬する。
これを 1 クールとし、投与を繰り返す。なお、投与量は、年
齢、疾患、症状により適宜増減する。
効能・効果及び
用法・用量以外
の要望内容(剤
形追加等)
備考
2. 要望内容における医療上の必要性について
(1)適応疾病の重篤性についての該当性
子宮体癌は致死的な疾患であり、適応疾病の重篤性は「ア 生命に重大な影響がある疾
患(致死的な疾患)」に該当すると判断した。
(2)医療上の有用性についての該当性
要望内容について欧米等 6 カ国では承認されていないものの、欧米等の診療ガイドライ
ン及び教科書の記載内容、並びに国内外の臨床試験成績等から、①カルボプラチンとパク
リタキセルとの併用投与及び②カルボプラチンとドセタキセル水和物との併用投与は、子
宮体癌(進行・再発、術後再発高リスク等)患者に対して欧米等において標準的療法に位
置付けられており、国内外の医療環境の違い等を踏まえても、国内における有用性が期待
できると考えられる。したがって、
「ウ 欧米において標準的療法に位置づけられており、
国内外の医療環境の違い等を踏まえても国内における有用性が期待できると考えられる」
1