よむ、つかう、まなぶ。
資料3-3 カルボプラチン (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00031.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第57回 ) |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
論文
備考
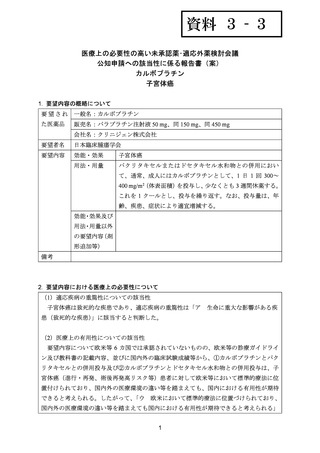
4.要望内容について企業側で実施した海外臨床試験成績について
企業により実施した海外臨床試験はない。
5.要望内容に係る国内外の公表文献・成書等について
(1)無作為化比較試験、薬物動態試験等の公表論文としての報告状況
<海外における臨床試験等>
1) Miller D, Filiaci V, Fleming G, et al. Randomized phase III noninferiority trial of first line
chemotherapy for metastatic or recurrent endometrial carcinoma: A Gynecologic Oncology
Group study. Gynecol Oncol 2012; 125(3):771 [abstract] 3)
Miller DS, Filiaci VL, Mannel RS, et al. Carboplatin and Paclitaxel for Advanced Endometrial
Cancer: Final Overall Survival and Adverse Event Analysis of a Phase III Trial (NRG
Oncology/GOG0209). J Clin Oncol 2020; 38: 3841-50 13)
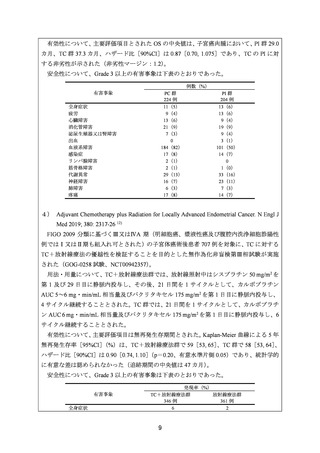
治療歴のない FIGO 分類に基づくⅢ/Ⅳ期又は再発の子宮体癌患者 1,381 例を対象に、パ
クリタキセル、ドキソルビシン塩酸塩(以下、「ドキソルビシン」)及びシスプラチンの併
用投与(以下、「TAP」)に対するカルボプラチンとパクリタキセルとの併用投与(以下、
「TC」)の非劣性を検証することを目的とした無作為化非盲検国際共同第Ⅲ相試験が実施
された(GOG-0209 試験、NCT00063999)
。
用法・用量は、21 日間を 1 サイクルとして、TC 群ではカルボプラチン AUC 6 mg・min/mL
相当量及びパクリタキセル 175 mg/m2 を第 1 日目に静脈内投与、TAP 群ではドキソルビシ
ン 45 mg/m2 及びシスプラチン 50 mg/m2 を第 1 日目に、パクリタキセル 160 mg/m2 を第 2 日
目に静脈内投与することとされ、いずれの群も 7 サイクル又は病勢進行若しくは許容でき
ない毒性が認められるまで継続することとされた(2008 年に治験実施計画書の改訂が行わ
れ、TC 群の骨盤/脊椎照射歴のある患者ではパクリタキセル 135 mg/m2、カルボプラチン
AUC 5 mg・min/mL 相当量に減量することとされた)。
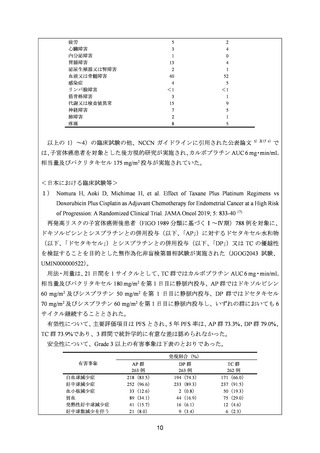
有効性について、主要評価項目とされた全生存期間(以下、
「OS」
)の第 2 回中間解析に
おける中央値は、TC 群 32 カ月、TAP 群 38 カ月、ハザード比は 1.01 であり、90%信頼区間
(以下、「CI」)の上限は 1.16 で非劣性マージン 1.2 を下回ったことから、TC の TAP に対
する非劣性が示された。最終解析における OS の中央値は、TC 群 37.0 カ月、TAP 群 41.1 カ
月、ハザード比[90%CI]は 1.002[0.895, 1.121]であった。
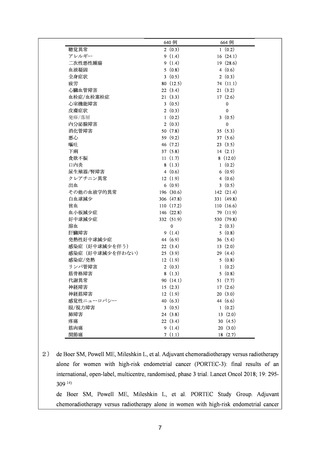
安全性について、Grade 3 以上の有害事象は下表のとおりであった。
例数(%)
有害事象
TAP 群
6
TC 群
備考
4.要望内容について企業側で実施した海外臨床試験成績について
企業により実施した海外臨床試験はない。
5.要望内容に係る国内外の公表文献・成書等について
(1)無作為化比較試験、薬物動態試験等の公表論文としての報告状況
<海外における臨床試験等>
1) Miller D, Filiaci V, Fleming G, et al. Randomized phase III noninferiority trial of first line
chemotherapy for metastatic or recurrent endometrial carcinoma: A Gynecologic Oncology
Group study. Gynecol Oncol 2012; 125(3):771 [abstract] 3)
Miller DS, Filiaci VL, Mannel RS, et al. Carboplatin and Paclitaxel for Advanced Endometrial
Cancer: Final Overall Survival and Adverse Event Analysis of a Phase III Trial (NRG
Oncology/GOG0209). J Clin Oncol 2020; 38: 3841-50 13)
治療歴のない FIGO 分類に基づくⅢ/Ⅳ期又は再発の子宮体癌患者 1,381 例を対象に、パ
クリタキセル、ドキソルビシン塩酸塩(以下、「ドキソルビシン」)及びシスプラチンの併
用投与(以下、「TAP」)に対するカルボプラチンとパクリタキセルとの併用投与(以下、
「TC」)の非劣性を検証することを目的とした無作為化非盲検国際共同第Ⅲ相試験が実施
された(GOG-0209 試験、NCT00063999)
。
用法・用量は、21 日間を 1 サイクルとして、TC 群ではカルボプラチン AUC 6 mg・min/mL
相当量及びパクリタキセル 175 mg/m2 を第 1 日目に静脈内投与、TAP 群ではドキソルビシ
ン 45 mg/m2 及びシスプラチン 50 mg/m2 を第 1 日目に、パクリタキセル 160 mg/m2 を第 2 日
目に静脈内投与することとされ、いずれの群も 7 サイクル又は病勢進行若しくは許容でき
ない毒性が認められるまで継続することとされた(2008 年に治験実施計画書の改訂が行わ
れ、TC 群の骨盤/脊椎照射歴のある患者ではパクリタキセル 135 mg/m2、カルボプラチン
AUC 5 mg・min/mL 相当量に減量することとされた)。
有効性について、主要評価項目とされた全生存期間(以下、
「OS」
)の第 2 回中間解析に
おける中央値は、TC 群 32 カ月、TAP 群 38 カ月、ハザード比は 1.01 であり、90%信頼区間
(以下、「CI」)の上限は 1.16 で非劣性マージン 1.2 を下回ったことから、TC の TAP に対
する非劣性が示された。最終解析における OS の中央値は、TC 群 37.0 カ月、TAP 群 41.1 カ
月、ハザード比[90%CI]は 1.002[0.895, 1.121]であった。
安全性について、Grade 3 以上の有害事象は下表のとおりであった。
例数(%)
有害事象
TAP 群
6
TC 群