よむ、つかう、まなぶ。
資料3-3 カルボプラチン (15 ページ)
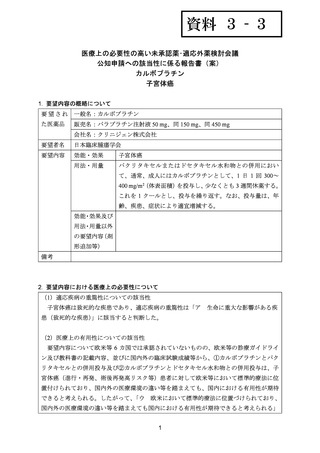
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00031.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第57回 ) |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
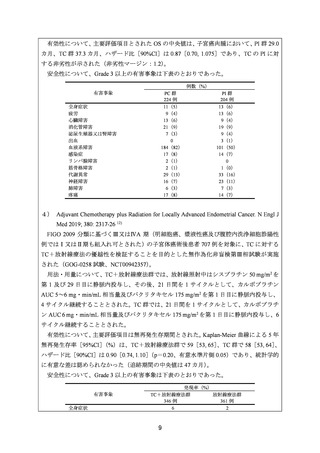
GOG-0258 試験
主要評価項目は無再発生存とされた。Kaplan-Meier 曲線による 5 年無再発生存率
[95%CI]
(%)は、TC+放射線療法群で 59[53, 65]
、TC 群で 58[53, 64]
、ハザード比[90%CI]
は 0.90[0.74, 1.10]
(p=0.20)であり、統計学的に有意な差は認められなかった(追跡期間
の中央値は 47 カ月)。
<国内臨床試験>
JGOG2043 試験 17)
主要評価項目は PFS とされ、5 年 PFS 率は、AP 群 73.3%、DP 群 79.0%、TC 群 73.9%で
あり、3 群間に統計学的に有意な差は認められなかった。
JGOG2041 試験 8)
主要評価項目とされた奏効率[95%CI]
(%)は、DP 群 51.7[32.5, 70.6]
、DC 群 48.3[29.4,
67.5]、TC 群 60.0[40.6, 77.3]であった。
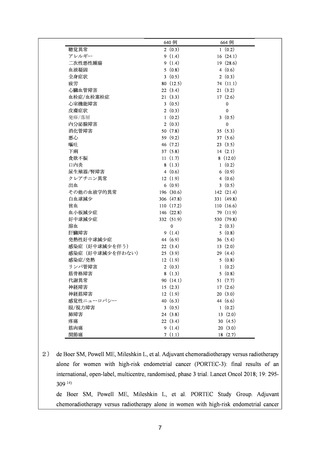
検討会議は、以上の国内外の臨床試験成績並びに国際的な診療ガイドライン及び教科書
の記載内容等を踏まえ、子宮体癌に対する TC 及び DC の有効性は期待できると考える。
(2)要望内容に係る外国人におけるエビデンス及び日本人における安全性の総合評価につい
て
国内外の公表論文において、子宮体癌に対して、TC 又は DC を施行した際に認められた
主な Grade 3 以上の有害事象は、本邦の添付文書で既に記載されている事象の範囲内であ
った(「5.要望内容に係る国内外の公表文献・成書等について」の項参照)
。また、既に本
邦において「乳癌」の効能・効果で 300~400 mg/m2、3 週間ごとの投与が承認されており、
国内外の診療ガイドラインにおいて子宮体癌に対して推奨されているカルボプラチンの用
法・用量(AUC 5~6 mg・min/mL 相当量、3 週間ごと)は当該承認の範囲を超えないと考
えられること*も踏まえると、AUC 5~6 mg・min/mL 相当量、3 週間ごと投与による日本人
の安全性に関する多くのエビデンスが蓄積されていると考える。
*:第 7 回医療上の必要性の高い未承認薬・適応外薬検討会議(平成 23 年 4 月 18 日開催)で報告された、
「公知申請への該当性に係る報告書:カルボプラチン(乳癌)
」において、海外で用いられている AUC
6 mg・min/mL 相当量について、本邦で実施した製造販売後特別調査(AUC 値に基づく投与における
安全性と有効性を確認するために実施された調査)において、15 例のほとんどが既承認の用量の範囲
内(1 回 300~400 mg/m2)に収まっていたことから、本邦では 300~400 mg/m2 とすることが適当と判
断されている。当該報告書を踏まえ、上記の用法・用量が平成 23 年 11 月 25 日に承認された(パラプ
ラチン注射液 50 mg、同 100 mg、同 450 mg)
。
以上より、検討会議は以下のように考える。
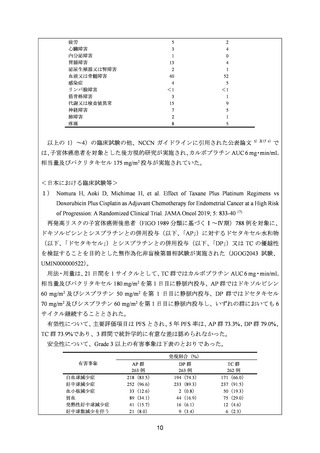
国内外の臨床試験成績より、子宮体癌患者に対する TC 及び DC による主な有害事象は、
いずれもカルボプラチン又は併用薬の本邦の添付文書で既に注意喚起されている有害事象
15
主要評価項目は無再発生存とされた。Kaplan-Meier 曲線による 5 年無再発生存率
[95%CI]
(%)は、TC+放射線療法群で 59[53, 65]
、TC 群で 58[53, 64]
、ハザード比[90%CI]
は 0.90[0.74, 1.10]
(p=0.20)であり、統計学的に有意な差は認められなかった(追跡期間
の中央値は 47 カ月)。
<国内臨床試験>
JGOG2043 試験 17)
主要評価項目は PFS とされ、5 年 PFS 率は、AP 群 73.3%、DP 群 79.0%、TC 群 73.9%で
あり、3 群間に統計学的に有意な差は認められなかった。
JGOG2041 試験 8)
主要評価項目とされた奏効率[95%CI]
(%)は、DP 群 51.7[32.5, 70.6]
、DC 群 48.3[29.4,
67.5]、TC 群 60.0[40.6, 77.3]であった。
検討会議は、以上の国内外の臨床試験成績並びに国際的な診療ガイドライン及び教科書
の記載内容等を踏まえ、子宮体癌に対する TC 及び DC の有効性は期待できると考える。
(2)要望内容に係る外国人におけるエビデンス及び日本人における安全性の総合評価につい
て
国内外の公表論文において、子宮体癌に対して、TC 又は DC を施行した際に認められた
主な Grade 3 以上の有害事象は、本邦の添付文書で既に記載されている事象の範囲内であ
った(「5.要望内容に係る国内外の公表文献・成書等について」の項参照)
。また、既に本
邦において「乳癌」の効能・効果で 300~400 mg/m2、3 週間ごとの投与が承認されており、
国内外の診療ガイドラインにおいて子宮体癌に対して推奨されているカルボプラチンの用
法・用量(AUC 5~6 mg・min/mL 相当量、3 週間ごと)は当該承認の範囲を超えないと考
えられること*も踏まえると、AUC 5~6 mg・min/mL 相当量、3 週間ごと投与による日本人
の安全性に関する多くのエビデンスが蓄積されていると考える。
*:第 7 回医療上の必要性の高い未承認薬・適応外薬検討会議(平成 23 年 4 月 18 日開催)で報告された、
「公知申請への該当性に係る報告書:カルボプラチン(乳癌)
」において、海外で用いられている AUC
6 mg・min/mL 相当量について、本邦で実施した製造販売後特別調査(AUC 値に基づく投与における
安全性と有効性を確認するために実施された調査)において、15 例のほとんどが既承認の用量の範囲
内(1 回 300~400 mg/m2)に収まっていたことから、本邦では 300~400 mg/m2 とすることが適当と判
断されている。当該報告書を踏まえ、上記の用法・用量が平成 23 年 11 月 25 日に承認された(パラプ
ラチン注射液 50 mg、同 100 mg、同 450 mg)
。
以上より、検討会議は以下のように考える。
国内外の臨床試験成績より、子宮体癌患者に対する TC 及び DC による主な有害事象は、
いずれもカルボプラチン又は併用薬の本邦の添付文書で既に注意喚起されている有害事象
15