よむ、つかう、まなぶ。
資料3-3 カルボプラチン (11 ページ)
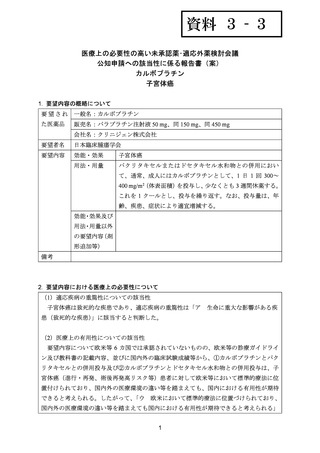
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00031.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第57回 ) |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
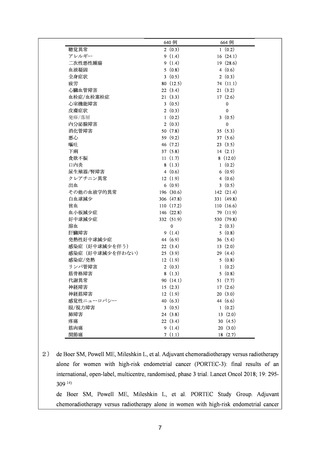
感染
食欲不振
悪心
嘔吐
19(7.3)
16(6.1)
15(5.7)
18(6.9)
13(5.0)
12(4.6)
5(1.9)
2(0.8)
2(0.8)
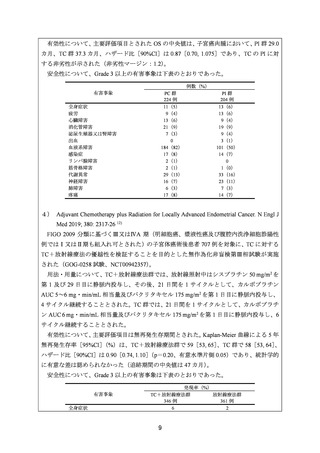
2) Nomura H, Aoki D, Takahashi F, et al. Randomized phase II study comparing docetaxel plus
cisplatin, docetaxel plus carboplatin, and paclitaxel plus carboplatin in patients with advanced
or recurrent endometrial carcinoma: a Japanese Gynecologic Oncology Group study
(JGOG2041). Ann Oncol 2011; 22: 636-42 6)
FIGO 分類に基づくⅢ/Ⅳ期又は再発の子宮体癌患者 90 例を対象に、DP、カルボプラチ
ンとドセタキセルとの併用投与(以下、「DC」
)及び TC の有効性・安全性を検討すること
を 目 的 と し た 無 作 為 化 非 盲 検 第 Ⅱ 相 試 験 が 実 施 さ れ た ( JGOG2041 試 験 、
UMINC000000170)。
用法・用量は、21 日間を 1 サイクルとして、カルボプラチン AUC 6 mg・min/mL 相当量
及びドセタキセル 60 mg/m2 若しくはパクリタキセル 180 mg/m2、
又はドセタキセル 70 mg/m2
及びシスプラチン 60 mg/m2 を第 1 日目に静脈内投与し、病勢進行又は許容できない毒性が
認められるまで継続することとされた。
有効性について、主要評価項目とされた奏効率[95%CI]
(%)は、DP 群 51.7[32.5, 70.6]
、
DC 群 48.3[29.4, 67.5]、TC 群 60.0[40.6, 77.3]であった。
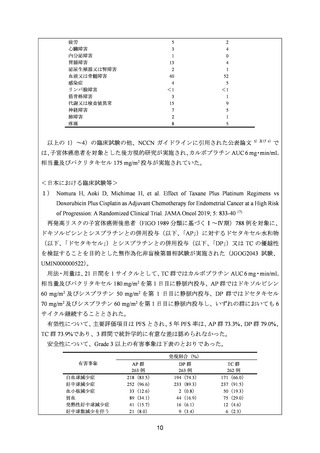
安全性について、Grade 3 以上の有害事象は下表のとおりであった。
発現割合(%)
有害事象
貧血
白血球減少症
好中球減少症
血小板減少症
AST 増加
ALT 増加
アレルギー反応
食欲不振
下痢
悪心
運動性ニューロパチー
感覚性ニューロパチー
発熱性好中球減少症
DP 群
30 例
1(3.3)
22(73.3)
25(83.3)
2(6.7)
0
0
1(3.3)
5(16.7)
4(13.3)
3(10.0)
0
0
3(10.0)
DC 群
30 例
6(16.7)
26(86.7)
27(90.0)
3(10.0)
1(3.3)
1(3.3)
0
3(10.0)
1(3.3)
2(6.7)
0
0
2(6.7)
TC 群
30 例
5(16.7)
15(50.0)
23(76.6)
3(10.0)
1(3.3)
0
0
3(10.0)
0
3(10.0)
2(6.7)
1(3.3)
1(3.3)
(2)Peer-reviewed journal の総説、メタ・アナリシス等の報告状況
1) Morice P, Leary A, Creutzberg C, et al. Endometrial cancer. Lancet 2016; 387: 1094-108 18)
局所療法の適応とならない再発の子宮体癌に対して、TC は TAP と同程度に有効であり、
毒性は少なく、一次治療の選択肢として使用されることが多い旨が記載されている。
11
食欲不振
悪心
嘔吐
19(7.3)
16(6.1)
15(5.7)
18(6.9)
13(5.0)
12(4.6)
5(1.9)
2(0.8)
2(0.8)
2) Nomura H, Aoki D, Takahashi F, et al. Randomized phase II study comparing docetaxel plus
cisplatin, docetaxel plus carboplatin, and paclitaxel plus carboplatin in patients with advanced
or recurrent endometrial carcinoma: a Japanese Gynecologic Oncology Group study
(JGOG2041). Ann Oncol 2011; 22: 636-42 6)
FIGO 分類に基づくⅢ/Ⅳ期又は再発の子宮体癌患者 90 例を対象に、DP、カルボプラチ
ンとドセタキセルとの併用投与(以下、「DC」
)及び TC の有効性・安全性を検討すること
を 目 的 と し た 無 作 為 化 非 盲 検 第 Ⅱ 相 試 験 が 実 施 さ れ た ( JGOG2041 試 験 、
UMINC000000170)。
用法・用量は、21 日間を 1 サイクルとして、カルボプラチン AUC 6 mg・min/mL 相当量
及びドセタキセル 60 mg/m2 若しくはパクリタキセル 180 mg/m2、
又はドセタキセル 70 mg/m2
及びシスプラチン 60 mg/m2 を第 1 日目に静脈内投与し、病勢進行又は許容できない毒性が
認められるまで継続することとされた。
有効性について、主要評価項目とされた奏効率[95%CI]
(%)は、DP 群 51.7[32.5, 70.6]
、
DC 群 48.3[29.4, 67.5]、TC 群 60.0[40.6, 77.3]であった。
安全性について、Grade 3 以上の有害事象は下表のとおりであった。
発現割合(%)
有害事象
貧血
白血球減少症
好中球減少症
血小板減少症
AST 増加
ALT 増加
アレルギー反応
食欲不振
下痢
悪心
運動性ニューロパチー
感覚性ニューロパチー
発熱性好中球減少症
DP 群
30 例
1(3.3)
22(73.3)
25(83.3)
2(6.7)
0
0
1(3.3)
5(16.7)
4(13.3)
3(10.0)
0
0
3(10.0)
DC 群
30 例
6(16.7)
26(86.7)
27(90.0)
3(10.0)
1(3.3)
1(3.3)
0
3(10.0)
1(3.3)
2(6.7)
0
0
2(6.7)
TC 群
30 例
5(16.7)
15(50.0)
23(76.6)
3(10.0)
1(3.3)
0
0
3(10.0)
0
3(10.0)
2(6.7)
1(3.3)
1(3.3)
(2)Peer-reviewed journal の総説、メタ・アナリシス等の報告状況
1) Morice P, Leary A, Creutzberg C, et al. Endometrial cancer. Lancet 2016; 387: 1094-108 18)
局所療法の適応とならない再発の子宮体癌に対して、TC は TAP と同程度に有効であり、
毒性は少なく、一次治療の選択肢として使用されることが多い旨が記載されている。
11