よむ、つかう、まなぶ。
資料3-3 カルボプラチン (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00031.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第57回 ) |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
5
3
1
13
2
40
4
<1
3
15
7
2
8
疲労
心臓障害
内分泌障害
胃腸障害
泌尿生殖器又は腎障害
血液又は骨髄障害
感染症
リンパ腺障害
筋骨格障害
代謝又は検査値異常
神経障害
肺障害
疼痛
2
4
0
4
1
52
5
<1
1
9
5
1
5
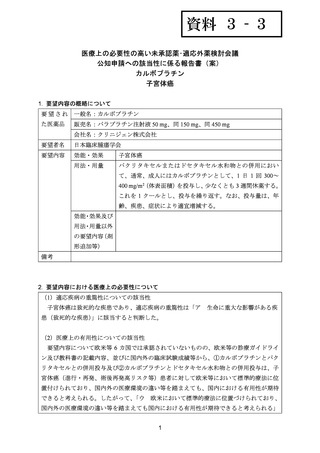
以上の 1)~4)の臨床試験の他、NCCN ガイドラインに引用された公表論文 3)及び 4)で
は、子宮体癌患者を対象とした後方視的研究が実施され、
カルボプラチン AUC 6 mg・min/mL
相当量及びパクリタキセル 175 mg/m2 投与が実施されていた。
<日本における臨床試験等>
1) Nomura H, Aoki D, Michimae H, et al. Effect of Taxane Plus Platinum Regimens vs
Doxorubicin Plus Cisplatin as Adjuvant Chemotherapy for Endometrial Cancer at a High Risk
of Progression: A Randomized Clinical Trial. JAMA Oncol 2019; 5: 833-40 17)
再発高リスクの子宮体癌術後患者(FIGO 1989 分類に基づくⅠ~Ⅳ期)788 例を対象に、
ドキソルビシンとシスプラチンとの併用投与(以下、
「AP」
)に対するドセタキセル水和物
(以下、「ドセタキセル」
)とシスプラチンとの併用投与(以下、
「DP」
)又は TC の優越性
を検証することを目的とした無作為化非盲検第Ⅲ相試験が実施された(JGOG2043 試験、
UMIN000000522)
。
用法・用量は、21 日間を 1 サイクルとして、TC 群ではカルボプラチン AUC 6 mg・min/mL
相当量及びパクリタキセル 180 mg/m2 を第 1 日目に静脈内投与、AP 群ではドキソルビシン
60 mg/m2 及びシスプラチン 50 mg/m2 を第 1 日目に静脈内投与、DP 群ではドセタキセル
70 mg/m2 及びシスプラチン 60 mg/m2 を第 1 日目に静脈内投与し、いずれの群においても 6
サイクル継続することとされた。
有効性について、主要評価項目は PFS とされ、5 年 PFS 率は、AP 群 73.3%、DP 群 79.0%、
TC 群 73.9%であり、3 群間で統計学的に有意な差は認められなかった。
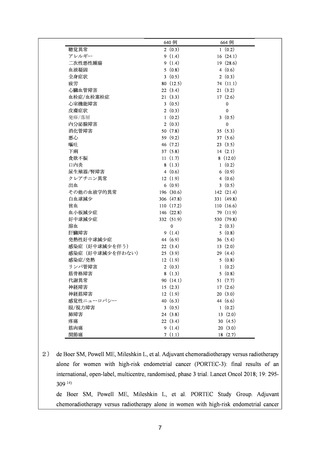
安全性について、Grade 3 以上の有害事象は下表のとおりであった。
発現割合(%)
有害事象
白血球減少症
好中球減少症
血小板減少症
貧血
発熱性好中球減少症
好中球数減少を伴う
AP 群
263 例
218(83.5)
252(96.6)
33(12.6)
89(34.1)
41(15.7)
21(8.0)
DP 群
263 例
194(74.3)
233(89.3)
2(0.8)
44(16.9)
16(6.1)
9(3.4)
10
TC 群
262 例
171(66.0)
237(91.5)
50(19.3)
75(29.0)
12(4.6)
6(2.3)
3
1
13
2
40
4
<1
3
15
7
2
8
疲労
心臓障害
内分泌障害
胃腸障害
泌尿生殖器又は腎障害
血液又は骨髄障害
感染症
リンパ腺障害
筋骨格障害
代謝又は検査値異常
神経障害
肺障害
疼痛
2
4
0
4
1
52
5
<1
1
9
5
1
5
以上の 1)~4)の臨床試験の他、NCCN ガイドラインに引用された公表論文 3)及び 4)で
は、子宮体癌患者を対象とした後方視的研究が実施され、
カルボプラチン AUC 6 mg・min/mL
相当量及びパクリタキセル 175 mg/m2 投与が実施されていた。
<日本における臨床試験等>
1) Nomura H, Aoki D, Michimae H, et al. Effect of Taxane Plus Platinum Regimens vs
Doxorubicin Plus Cisplatin as Adjuvant Chemotherapy for Endometrial Cancer at a High Risk
of Progression: A Randomized Clinical Trial. JAMA Oncol 2019; 5: 833-40 17)
再発高リスクの子宮体癌術後患者(FIGO 1989 分類に基づくⅠ~Ⅳ期)788 例を対象に、
ドキソルビシンとシスプラチンとの併用投与(以下、
「AP」
)に対するドセタキセル水和物
(以下、「ドセタキセル」
)とシスプラチンとの併用投与(以下、
「DP」
)又は TC の優越性
を検証することを目的とした無作為化非盲検第Ⅲ相試験が実施された(JGOG2043 試験、
UMIN000000522)
。
用法・用量は、21 日間を 1 サイクルとして、TC 群ではカルボプラチン AUC 6 mg・min/mL
相当量及びパクリタキセル 180 mg/m2 を第 1 日目に静脈内投与、AP 群ではドキソルビシン
60 mg/m2 及びシスプラチン 50 mg/m2 を第 1 日目に静脈内投与、DP 群ではドセタキセル
70 mg/m2 及びシスプラチン 60 mg/m2 を第 1 日目に静脈内投与し、いずれの群においても 6
サイクル継続することとされた。
有効性について、主要評価項目は PFS とされ、5 年 PFS 率は、AP 群 73.3%、DP 群 79.0%、
TC 群 73.9%であり、3 群間で統計学的に有意な差は認められなかった。
安全性について、Grade 3 以上の有害事象は下表のとおりであった。
発現割合(%)
有害事象
白血球減少症
好中球減少症
血小板減少症
貧血
発熱性好中球減少症
好中球数減少を伴う
AP 群
263 例
218(83.5)
252(96.6)
33(12.6)
89(34.1)
41(15.7)
21(8.0)
DP 群
263 例
194(74.3)
233(89.3)
2(0.8)
44(16.9)
16(6.1)
9(3.4)
10
TC 群
262 例
171(66.0)
237(91.5)
50(19.3)
75(29.0)
12(4.6)
6(2.3)