よむ、つかう、まなぶ。
【資料2-1】医薬品の品質確保に向けた取組みについて(医薬局からの説明資料) (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第14回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
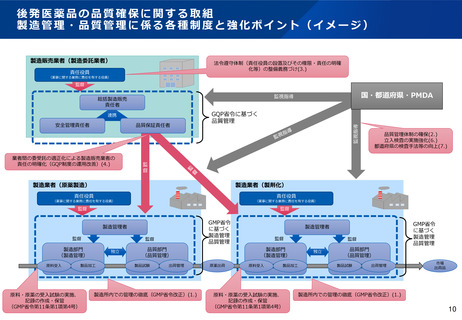
GMP省令改正(改正の趣旨及び原薬管理の強化)
改正の趣旨
➢ 国際整合
PIC/Sを中心とした国際的な監視体制の連携が進んできており、PIC/S加盟国として、
国際標準となっているPIC/Sガイドライン等との一層の整合化を図る。
➢ 国内制度整理
近年、国内外の製造所において発生した医薬品の品質に係る種々の事案(※)を踏まえ、
これまで通知等で示してきた内容をGMP省令に規定し、明確化することにより、GMP適用
の厳格化を図り、医薬品の品質の確保を進める。
(※)承認内容と製造実態との相違、製品の交叉汚染、製造記録の信頼性問題、等
➢ その他
現行GMP省令中にある用語の整理等
原 料 等 の 供 給 者 の 管 理 ( 第 十 一 条 の 四 ) 7,8)
〈新設〉
製造業者等に対し、
・原料等の品質の確保のために適切な規格を定めること
・原料等の供給者について、適格性を評価し、選定すること
・原料等の製造管理及び品質管理が適切かつ円滑に行われているかどうかを定期的に確認すること
等の業務を適切に行うことを義務づけた。
また、原料等の製造管理及び品質管理の方法に関して、その供給者と必要な取決めを締結することを義務づけた。
【参考文献】
7) PI 047 Annex “GUIDELINE ON THE PRINCIPLES OF GOOD DISTRIBUTION PRACTICE OF ACTIVE SUBSTANCES FOR MRDICINAL PRODUCTS FOR
HUMAN USE
8) PI 045 “GUIDELINES ON THE FORMALISED RISK ASSESSMENT FOR ASCERTAINING THE APPROPRIATE GOOD MANUFACTURING PRACTICE FOR
EXCIPIENTS OF MEDICINAL PRODUCTS FOR HUMAN USE
12
改正の趣旨
➢ 国際整合
PIC/Sを中心とした国際的な監視体制の連携が進んできており、PIC/S加盟国として、
国際標準となっているPIC/Sガイドライン等との一層の整合化を図る。
➢ 国内制度整理
近年、国内外の製造所において発生した医薬品の品質に係る種々の事案(※)を踏まえ、
これまで通知等で示してきた内容をGMP省令に規定し、明確化することにより、GMP適用
の厳格化を図り、医薬品の品質の確保を進める。
(※)承認内容と製造実態との相違、製品の交叉汚染、製造記録の信頼性問題、等
➢ その他
現行GMP省令中にある用語の整理等
原 料 等 の 供 給 者 の 管 理 ( 第 十 一 条 の 四 ) 7,8)
〈新設〉
製造業者等に対し、
・原料等の品質の確保のために適切な規格を定めること
・原料等の供給者について、適格性を評価し、選定すること
・原料等の製造管理及び品質管理が適切かつ円滑に行われているかどうかを定期的に確認すること
等の業務を適切に行うことを義務づけた。
また、原料等の製造管理及び品質管理の方法に関して、その供給者と必要な取決めを締結することを義務づけた。
【参考文献】
7) PI 047 Annex “GUIDELINE ON THE PRINCIPLES OF GOOD DISTRIBUTION PRACTICE OF ACTIVE SUBSTANCES FOR MRDICINAL PRODUCTS FOR
HUMAN USE
8) PI 045 “GUIDELINES ON THE FORMALISED RISK ASSESSMENT FOR ASCERTAINING THE APPROPRIATE GOOD MANUFACTURING PRACTICE FOR
EXCIPIENTS OF MEDICINAL PRODUCTS FOR HUMAN USE
12