よむ、つかう、まなぶ。
【資料2-1】医薬品の品質確保に向けた取組みについて(医薬局からの説明資料) (17 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第14回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
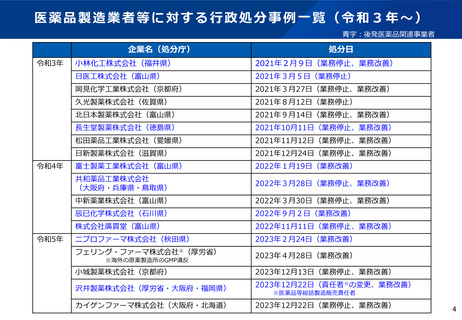
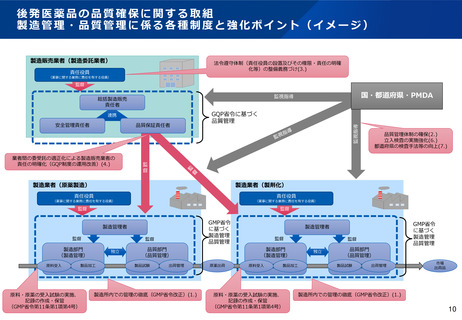
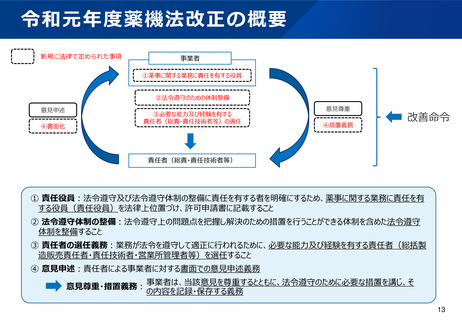
無通告立入検査ガイドラインの制定について
背景
•
令和2年12月、後発医薬品の製造過程において、承認書に記載の無い医薬品原薬が混入し、当該医薬品を
服用した患者に、重大な健康被害が多数生じる事案が発生した。
•
当該事案を踏まえ、都道府県に対し、リスクの高い製造所への無通告立入検査の実施頻度の増加に加え、
研修会やPMDAとの合同立入検査の活用等により、検査手法の向上に努めるよう、無通告立入検査の徹底
強化を進めてきた。
•
こうした検査手法の向上の一環として、より実効的な無通告立入検査を実施するため、令和3年12月に無
通告立入検査における基本姿勢や調査手法について示すこととした。
ガイドラインの目的
•
製造業者等における法令の遵守状況、医薬品の製造実態等を効果的に把握し、重大な法令違反や品質不良
等の端緒となる情報の検知及び不正行為等の抑止を目的とする。
ガイドラインの概要
•
網羅的ではなく、課題を特定し徹底的に深堀する調査を目標とし、対象施設の選定、計画の立案、調査中
の情報入手、処理、分析等の手法をまとめている。
※本ガイドラインは、公にすることにより、法令違反の発見及び指導を回避又は軽減するための事業者による
証拠隠滅や虚偽陳述を助長するおそれがあることから、非公開の取扱いとしている。
17
背景
•
令和2年12月、後発医薬品の製造過程において、承認書に記載の無い医薬品原薬が混入し、当該医薬品を
服用した患者に、重大な健康被害が多数生じる事案が発生した。
•
当該事案を踏まえ、都道府県に対し、リスクの高い製造所への無通告立入検査の実施頻度の増加に加え、
研修会やPMDAとの合同立入検査の活用等により、検査手法の向上に努めるよう、無通告立入検査の徹底
強化を進めてきた。
•
こうした検査手法の向上の一環として、より実効的な無通告立入検査を実施するため、令和3年12月に無
通告立入検査における基本姿勢や調査手法について示すこととした。
ガイドラインの目的
•
製造業者等における法令の遵守状況、医薬品の製造実態等を効果的に把握し、重大な法令違反や品質不良
等の端緒となる情報の検知及び不正行為等の抑止を目的とする。
ガイドラインの概要
•
網羅的ではなく、課題を特定し徹底的に深堀する調査を目標とし、対象施設の選定、計画の立案、調査中
の情報入手、処理、分析等の手法をまとめている。
※本ガイドラインは、公にすることにより、法令違反の発見及び指導を回避又は軽減するための事業者による
証拠隠滅や虚偽陳述を助長するおそれがあることから、非公開の取扱いとしている。
17