よむ、つかう、まなぶ。
【資料1】柳本構成員提出資料 (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37787.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第8回 2/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
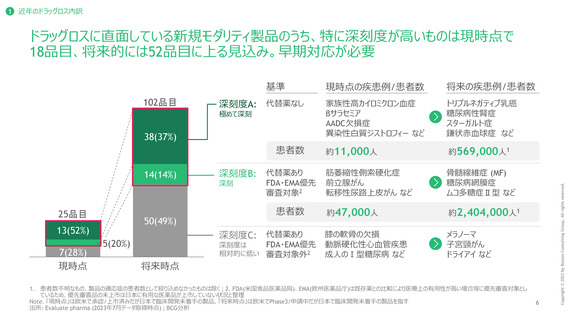
3 ドラッグロス解消に向けた打ち手の方向性
市場としての魅力を高めることが必要であるところ、日本市場に投資するうえでの最初の
ハードルとなる薬事面での障壁解消が必要
研究開発
製造流通
新規モダリティ研究・実用化サイクルの活性化
• 「創薬エコシステム」構築
• バイオバンクの使用促進、手続きの簡素化
臨床開発環境の向上 (日本特有の障壁の低減)
• 臨床研究拠点の集約・強化
• セントラルIRB(治験審査委員会)の普及
新規モダリティ向けサプライチェーン整備 (治験
• CMO/CDMOの機能強化、バイオ製造人材育成
• 細胞治療施設の統一認定基準策定
新規モダリティに即した新たな評価法の確立
• RWDや間接比較試験等の審査対象エビデンス拡充
• 海外事例も踏まえた国内治験デザインの前倒し検討 (個
別製品の治験相談を待たない)
• 優先審査/条件付き早期承認適用の拡大
制度設計・支援拡充等を機動的に実施しうる
体制の整備
• 治験の伴走支援
• 上記薬事関連施策の検討・推進を可能とする体制の整備
(RSセンターの拡充等)
薬価における新規モダリティ特有の付加価値や
エビデンス制約の考慮
• 承認審査参考資料/副次的評価項目の薬価反映
薬製造を含む)
薬事承認
保険償還
9
Copyright © 2023 by Boston Consulting Group. All rights reserved.
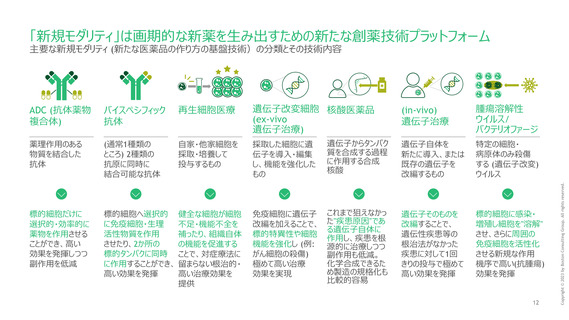
各プロセスにおける施策アイディア
市場としての魅力を高めることが必要であるところ、日本市場に投資するうえでの最初の
ハードルとなる薬事面での障壁解消が必要
研究開発
製造流通
新規モダリティ研究・実用化サイクルの活性化
• 「創薬エコシステム」構築
• バイオバンクの使用促進、手続きの簡素化
臨床開発環境の向上 (日本特有の障壁の低減)
• 臨床研究拠点の集約・強化
• セントラルIRB(治験審査委員会)の普及
新規モダリティ向けサプライチェーン整備 (治験
• CMO/CDMOの機能強化、バイオ製造人材育成
• 細胞治療施設の統一認定基準策定
新規モダリティに即した新たな評価法の確立
• RWDや間接比較試験等の審査対象エビデンス拡充
• 海外事例も踏まえた国内治験デザインの前倒し検討 (個
別製品の治験相談を待たない)
• 優先審査/条件付き早期承認適用の拡大
制度設計・支援拡充等を機動的に実施しうる
体制の整備
• 治験の伴走支援
• 上記薬事関連施策の検討・推進を可能とする体制の整備
(RSセンターの拡充等)
薬価における新規モダリティ特有の付加価値や
エビデンス制約の考慮
• 承認審査参考資料/副次的評価項目の薬価反映
薬製造を含む)
薬事承認
保険償還
9
Copyright © 2023 by Boston Consulting Group. All rights reserved.
各プロセスにおける施策アイディア