よむ、つかう、まなぶ。
【資料1】柳本構成員提出資料 (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37787.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第8回 2/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
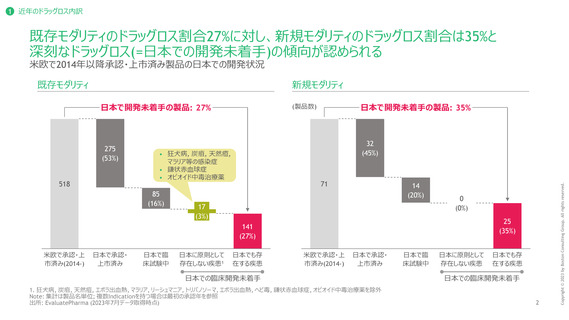
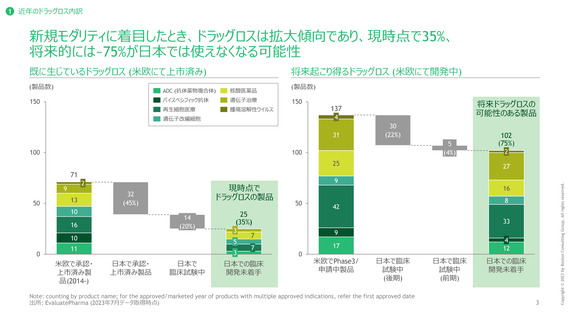
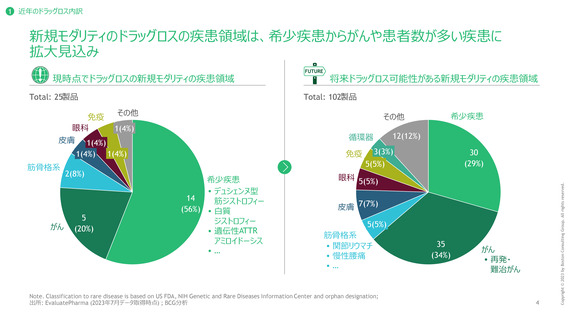
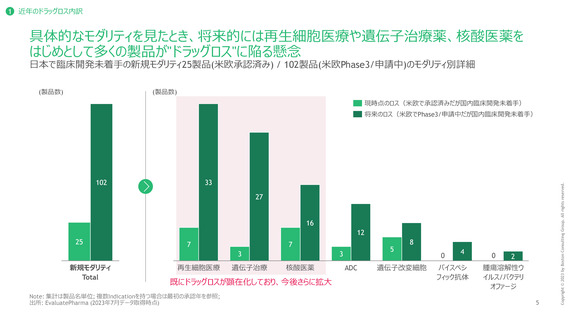
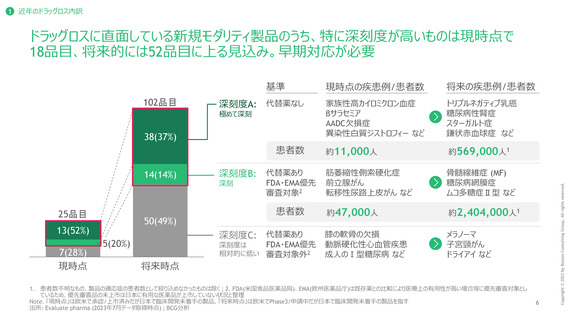
1 近年のドラッグロス内訳
基準
102品目
深刻度A: 代替薬なし
極めて深刻
38(37%)
患者数
46
25品目
13(52%)
13
7(28%)
現時点
14(14%)
深刻度B: 代替薬あり
深刻
FDA・EMA優先
審査対象2
患者数
50(49%)
深刻度C: 代替薬あり
50
5(20%)
深刻度は
相対的に低い
将来時点
FDA・EMA優先
審査対象外2
現時点の疾患例/患者数
将来の疾患例/患者数
家族性高カイロミクロン血症
βサラセミア
AADC欠損症
異染性白質ジストロフィー など
トリプルネガティブ乳癌
糖尿病性腎症
スターガルト症
鎌状赤血球症 など
約11,000人
約569,000人1
筋萎縮性側索硬化症
前立腺がん
転移性尿路上皮がん など
骨髄線維症 (MF)
糖尿病網膜症
ムコ多糖症Ⅱ型 など
約47,000人
約2,404,000人1
膝の軟骨の欠損
動脈硬化性心血管疾患
成人のⅠ型糖尿病 など
メラノーマ
子宮頸がん
ドライアイ など
1. 患者数不明なもの、製品の適応症の患者数として絞り込めなかったものは除く ; 2. FDA(米国食品医薬品局)、EMA(欧州医薬品庁)は既存薬との比較により医療上の有用性が高い場合等に優先審査対象とし
ているため、優先審査品の未上市は日本に有用な医薬品が上市していない状況と整理
Note. 「現時点」は欧米で承認/上市済みだが日本で臨床開発未着手の製品、「将来時点」は欧米でPhase3/申請中だが日本で臨床開発未着手の製品を指す
出所: Evaluate pharma (2023年7月データ取得時点) ; BCG分析
6
Copyright © 2023 by Boston Consulting Group. All rights reserved.
ドラッグロスに直面している新規モダリティ製品のうち、特に深刻度が高いものは現時点で
18品目、将来的には52品目に上る見込み。早期対応が必要
基準
102品目
深刻度A: 代替薬なし
極めて深刻
38(37%)
患者数
46
25品目
13(52%)
13
7(28%)
現時点
14(14%)
深刻度B: 代替薬あり
深刻
FDA・EMA優先
審査対象2
患者数
50(49%)
深刻度C: 代替薬あり
50
5(20%)
深刻度は
相対的に低い
将来時点
FDA・EMA優先
審査対象外2
現時点の疾患例/患者数
将来の疾患例/患者数
家族性高カイロミクロン血症
βサラセミア
AADC欠損症
異染性白質ジストロフィー など
トリプルネガティブ乳癌
糖尿病性腎症
スターガルト症
鎌状赤血球症 など
約11,000人
約569,000人1
筋萎縮性側索硬化症
前立腺がん
転移性尿路上皮がん など
骨髄線維症 (MF)
糖尿病網膜症
ムコ多糖症Ⅱ型 など
約47,000人
約2,404,000人1
膝の軟骨の欠損
動脈硬化性心血管疾患
成人のⅠ型糖尿病 など
メラノーマ
子宮頸がん
ドライアイ など
1. 患者数不明なもの、製品の適応症の患者数として絞り込めなかったものは除く ; 2. FDA(米国食品医薬品局)、EMA(欧州医薬品庁)は既存薬との比較により医療上の有用性が高い場合等に優先審査対象とし
ているため、優先審査品の未上市は日本に有用な医薬品が上市していない状況と整理
Note. 「現時点」は欧米で承認/上市済みだが日本で臨床開発未着手の製品、「将来時点」は欧米でPhase3/申請中だが日本で臨床開発未着手の製品を指す
出所: Evaluate pharma (2023年7月データ取得時点) ; BCG分析
6
Copyright © 2023 by Boston Consulting Group. All rights reserved.
ドラッグロスに直面している新規モダリティ製品のうち、特に深刻度が高いものは現時点で
18品目、将来的には52品目に上る見込み。早期対応が必要