よむ、つかう、まなぶ。
【資料1】柳本構成員提出資料 (14 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37787.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第8回 2/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
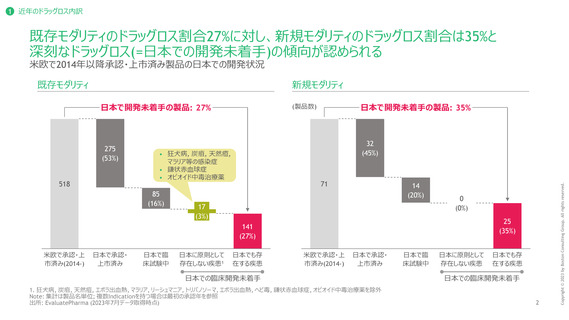
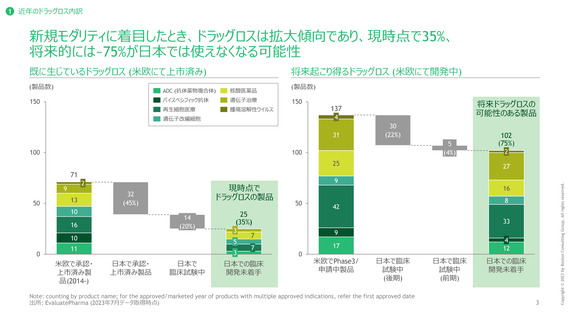
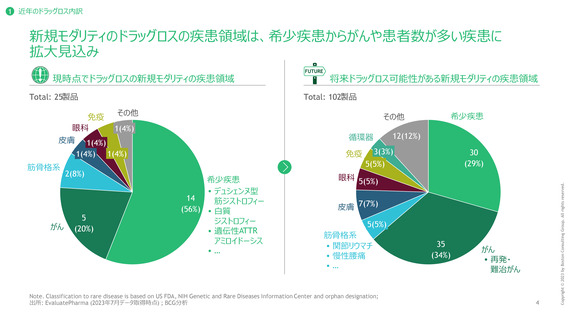
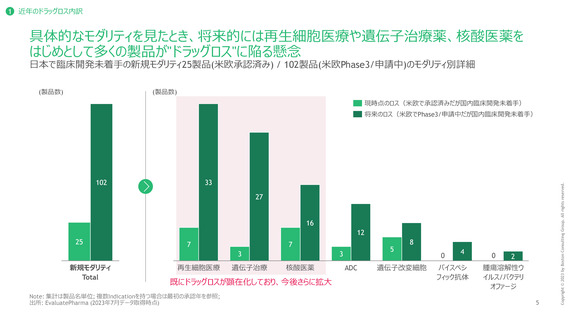
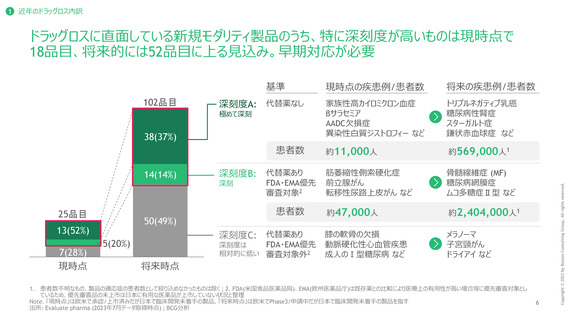
ドラッグラグ・ロス製品の深刻度の評価方法
日本における代替薬の有無、FDA, EMAにおいて優先審査対象として指定されているか否かによって試行的に評価
代替薬があるか1
FDA・EMAの優先審査対象として指定されているか
評価観点の
Rationale
適応症に対する薬物療法が存
在しない場合、UMNs (Unmet
Medical Needs) が大きい
FDA・EMA2は既存薬との比較により医療上の有用性が高い場合
等に優先審査対象としているため、優先審査品の未上市は日本
に有用な医薬品が上市していない状況であると言える
評価観点に
よる区分
代替薬なし
代替薬あり
深刻度評価
A (極めて深刻)
First track,
Breakthrough
重篤疾患のUMNsを満たす、革新的に既存
療法を上回る可能性のある新薬
RMAT
重篤疾患のUMNsを満たす、既存療法を上回
る可能性のある再生医療療法
Accelerated
approval
重篤疾患のUMNsを満たしうるが、まだ臨床上
の効果が十分証明されておらず、追加の試験
が必要な新薬
Priority review
既存薬の有効性か安全性を大きく改善する
新薬
指定なし
B (深刻)
C (深刻度は
相対的に低い)
1. 個々の適応症に対する薬物療法の有無で区分しており「代替薬なし」には非薬物療法が存在する場合を含む ; 個々の薬剤に対し適応症が複数存在する場合、複数の適応症のうち一つでも代替薬が存在しない
場合は「代替薬なし」としてカウント 2. EMAの優先審査対象の品目は全てFDAの優先審査対象の中に包含されているため、実質的にFDAの優先審査の指定有無を分類に採用している
13
Copyright © 2021 by Boston Consulting Group. All rights reserved.
深刻度評価
の観点
日本における代替薬の有無、FDA, EMAにおいて優先審査対象として指定されているか否かによって試行的に評価
代替薬があるか1
FDA・EMAの優先審査対象として指定されているか
評価観点の
Rationale
適応症に対する薬物療法が存
在しない場合、UMNs (Unmet
Medical Needs) が大きい
FDA・EMA2は既存薬との比較により医療上の有用性が高い場合
等に優先審査対象としているため、優先審査品の未上市は日本
に有用な医薬品が上市していない状況であると言える
評価観点に
よる区分
代替薬なし
代替薬あり
深刻度評価
A (極めて深刻)
First track,
Breakthrough
重篤疾患のUMNsを満たす、革新的に既存
療法を上回る可能性のある新薬
RMAT
重篤疾患のUMNsを満たす、既存療法を上回
る可能性のある再生医療療法
Accelerated
approval
重篤疾患のUMNsを満たしうるが、まだ臨床上
の効果が十分証明されておらず、追加の試験
が必要な新薬
Priority review
既存薬の有効性か安全性を大きく改善する
新薬
指定なし
B (深刻)
C (深刻度は
相対的に低い)
1. 個々の適応症に対する薬物療法の有無で区分しており「代替薬なし」には非薬物療法が存在する場合を含む ; 個々の薬剤に対し適応症が複数存在する場合、複数の適応症のうち一つでも代替薬が存在しない
場合は「代替薬なし」としてカウント 2. EMAの優先審査対象の品目は全てFDAの優先審査対象の中に包含されているため、実質的にFDAの優先審査の指定有無を分類に採用している
13
Copyright © 2021 by Boston Consulting Group. All rights reserved.
深刻度評価
の観点