よむ、つかう、まなぶ。
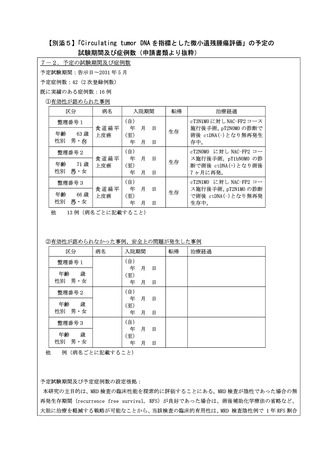
別紙3○先進医療Aに係る新規技術の科学的評価等について (10 ページ)
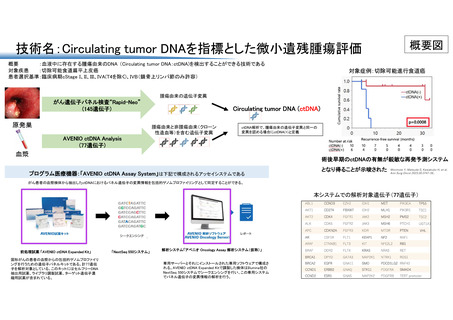
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00066.html |
| 出典情報 | 先進医療会議(第129回 2/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
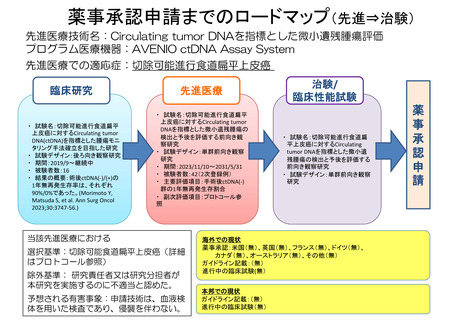
薬事承認申請までのロードマップ(先進⇒治験)
先進医療技術名:Circulating tumor DNAを指標とした微小遺残腫瘍評価
プログラム医療機器:AVENIO ctDNA Assay System
先進医療での適応症:切除可能進行食道扁平上皮癌
臨床研究
・ 試験名:切除可能進行食道扁平
上皮癌に対するCirculating tumor
DNA(ctDNA)を指標とした腫瘍モニ
タリング手法確立を目指した研究
・ 試験デザイン:後ろ向き観察研究
・ 期間:2019/9~継続中
・ 被験者数:16
・ 結果の概要:術後ctDNA(-)/(+)の
1年無再発生存率は、それぞれ
90%/0%であった。(Morimoto Y,
Matsuda S, et al. Ann Surg Oncol
2023;30:3747-56.)
先進医療
・ 試験名:切除可能進行食道扁平
上皮癌に対するCirculating tumor
DNAを指標とした微小遺残腫瘍の
検出と予後を評価する前向き観
察研究
・ 試験デザイン:単群前向き観察
研究
・ 期間:2023/11/10~2031/5/31
・ 被験者数:42(2次登録例)
・ 主要評価項目:手術後ctDNA(-)
群の1年無再発生存割合
・ 副次評価項目:プロトコール参
照
当該先進医療における
選択基準:切除可能食道扁平上皮癌(詳細
はプロトコール参照)
除外基準: 研究責任者又は研究分担者が
本研究を実施するのに不適当と認めた。
予想される有害事象:申請技術は、血液検
体を用いた検査であり、侵襲を伴わない。
治験/
臨床性能試験
・ 試験名:切除可能進行食道扁
平上皮癌に対するCirculating
tumor DNAを指標とした微小遺
残腫瘍の検出と予後を評価する
前向き観察研究
・ 試験デザイン:単群前向き観察
研究
海外での現状
薬事承認:米国(無)、英国(無)、フランス(無)、ドイツ(無)、
カナダ(無)、オーストラリア(無)、その他(無)
ガイドライン記載:(無)
進行中の臨床試験(無)
本邦での現状
ガイドライン記載:(無)
10
進行中の臨床試験(無)
薬
事
承
認
申
請
先進医療技術名:Circulating tumor DNAを指標とした微小遺残腫瘍評価
プログラム医療機器:AVENIO ctDNA Assay System
先進医療での適応症:切除可能進行食道扁平上皮癌
臨床研究
・ 試験名:切除可能進行食道扁平
上皮癌に対するCirculating tumor
DNA(ctDNA)を指標とした腫瘍モニ
タリング手法確立を目指した研究
・ 試験デザイン:後ろ向き観察研究
・ 期間:2019/9~継続中
・ 被験者数:16
・ 結果の概要:術後ctDNA(-)/(+)の
1年無再発生存率は、それぞれ
90%/0%であった。(Morimoto Y,
Matsuda S, et al. Ann Surg Oncol
2023;30:3747-56.)
先進医療
・ 試験名:切除可能進行食道扁平
上皮癌に対するCirculating tumor
DNAを指標とした微小遺残腫瘍の
検出と予後を評価する前向き観
察研究
・ 試験デザイン:単群前向き観察
研究
・ 期間:2023/11/10~2031/5/31
・ 被験者数:42(2次登録例)
・ 主要評価項目:手術後ctDNA(-)
群の1年無再発生存割合
・ 副次評価項目:プロトコール参
照
当該先進医療における
選択基準:切除可能食道扁平上皮癌(詳細
はプロトコール参照)
除外基準: 研究責任者又は研究分担者が
本研究を実施するのに不適当と認めた。
予想される有害事象:申請技術は、血液検
体を用いた検査であり、侵襲を伴わない。
治験/
臨床性能試験
・ 試験名:切除可能進行食道扁
平上皮癌に対するCirculating
tumor DNAを指標とした微小遺
残腫瘍の検出と予後を評価する
前向き観察研究
・ 試験デザイン:単群前向き観察
研究
海外での現状
薬事承認:米国(無)、英国(無)、フランス(無)、ドイツ(無)、
カナダ(無)、オーストラリア(無)、その他(無)
ガイドライン記載:(無)
進行中の臨床試験(無)
本邦での現状
ガイドライン記載:(無)
10
進行中の臨床試験(無)
薬
事
承
認
申
請