よむ、つかう、まなぶ。
別紙3○先進医療Aに係る新規技術の科学的評価等について (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00066.html |
| 出典情報 | 先進医療会議(第129回 2/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
様式第5号
先進医療の内容 (概要)
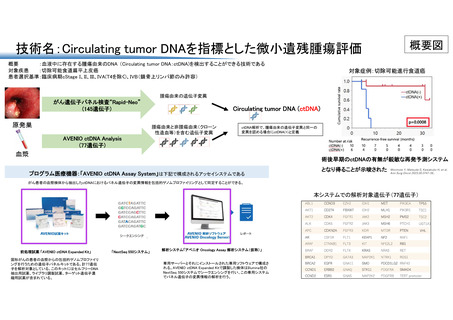
先進医療の名称:Circulating tumor DNA を指標とした微小遺残腫瘍評価
適応症:切除可能な進行食道扁平上皮癌
内容:
(先進性)
外科的切除可能な食道扁平上皮癌に対しては手術に化学療法、放射線療法を組み合わせた集学的
治療の開発が進んでいる。現在本邦では、標準治療は術後無治療経過観察となっているが、術前
化学療法+手術後の術後補助化学療法の上乗せ効果を検証するランダム化比較試験が計画中で
ある。仮に術後補助化学療法の有用性が示された場合には、将来的に術後補助化学療法が標準治
療になる可能性がある。しかし、食道癌手術後における術後補助化学療法は栄養状態や QOL 低
下につながる可能性があることに加え、ニボルマブの薬剤費といった経済的負担も大きい。そこ
で、術後再発率が低く、術後補助化学療法が不要な患者集団を特定し、術後補助化学療法を回避
することが望ましいが、その検査手法は確立されていない。
また、先述の通り現在の標準治療は無治療経過観察であるものの、欧米を中心とした臨床試験
の結果を根拠に、術後 1 年間のニボルマブ療法が保険適用となっている。そこで、一定の再発リ
スクを有する患者においては、現在においても、治療選択肢の 1 つとして術後ニボルマブ療法を
選択する場合がある。その適応は、術後の全身状態、手術検体の病理診断などにより、患者と主
治医チームの相談にもとづき、1 つのオプションとして、総合的に実施の有無を判断する必要が
あるのが現状だが、その精度は十分ではない。
(概要)
本試験の目的は、「根治切除可能な食道扁平上皮癌において、Circulating tumor DNA(ctDNA)
による微小遺残腫瘍(Minimal residual disease, MRD)検査結果陰性群の無再発生存割合が設
定した無再発生存割合の閾値を上回ること」を示すことにより、ctDNA を用いて判定された MRD
の予後予測因子としての有用性をあきらかにすることである。
切除可能な進行食道扁平上皮癌 (cT1N1-3, T2N0-3, M0-1(頚部リンパ節のみ)) を対象とする。
がん組織検体を治療前の生検時と手術検体から採取し、血液検体を治療前、NAC 後、術後1ヶ月、
術後3ヶ月、術後6ヶ月の時点で採取する。組織検体(生検または手術検体)と血液検体の解析
を行い、組織と血液のデータを照合することで血中循環腫瘍 DNA (circulating tumor DNA,ctDNA)
を検出し評価する。主要評価項目として、手術後 ctDNA(-)群の 1 年無再発生存割合を評価する。
(効果)
AVENIO ctDNA Assay System は血液中の遺伝子変異を検出し、がんに関連する 77 遺伝子の異常
を検出する臨床検査である。あらかじめ食道癌原発巣に存在する変異遺伝子を同定し、AVENIO
ctDNA Expanded kit によって検出された血液中の遺伝子変異を照合することで、ctDNA の評価が
可能となる。そして、手術後の ctDNA の陽性、陰性を主軸に、病理組織学的診断、画像診断など
を総合的に判断し、術後再発リスクを判定する。術後再発リスクにもとづき、術後補助化学療法
の必要性を検討する。
なお本邦では、食道癌の手術後において、免疫チェックポイント阻害剤であるニボルマブにつ
7
先進医療の内容 (概要)
先進医療の名称:Circulating tumor DNA を指標とした微小遺残腫瘍評価
適応症:切除可能な進行食道扁平上皮癌
内容:
(先進性)
外科的切除可能な食道扁平上皮癌に対しては手術に化学療法、放射線療法を組み合わせた集学的
治療の開発が進んでいる。現在本邦では、標準治療は術後無治療経過観察となっているが、術前
化学療法+手術後の術後補助化学療法の上乗せ効果を検証するランダム化比較試験が計画中で
ある。仮に術後補助化学療法の有用性が示された場合には、将来的に術後補助化学療法が標準治
療になる可能性がある。しかし、食道癌手術後における術後補助化学療法は栄養状態や QOL 低
下につながる可能性があることに加え、ニボルマブの薬剤費といった経済的負担も大きい。そこ
で、術後再発率が低く、術後補助化学療法が不要な患者集団を特定し、術後補助化学療法を回避
することが望ましいが、その検査手法は確立されていない。
また、先述の通り現在の標準治療は無治療経過観察であるものの、欧米を中心とした臨床試験
の結果を根拠に、術後 1 年間のニボルマブ療法が保険適用となっている。そこで、一定の再発リ
スクを有する患者においては、現在においても、治療選択肢の 1 つとして術後ニボルマブ療法を
選択する場合がある。その適応は、術後の全身状態、手術検体の病理診断などにより、患者と主
治医チームの相談にもとづき、1 つのオプションとして、総合的に実施の有無を判断する必要が
あるのが現状だが、その精度は十分ではない。
(概要)
本試験の目的は、「根治切除可能な食道扁平上皮癌において、Circulating tumor DNA(ctDNA)
による微小遺残腫瘍(Minimal residual disease, MRD)検査結果陰性群の無再発生存割合が設
定した無再発生存割合の閾値を上回ること」を示すことにより、ctDNA を用いて判定された MRD
の予後予測因子としての有用性をあきらかにすることである。
切除可能な進行食道扁平上皮癌 (cT1N1-3, T2N0-3, M0-1(頚部リンパ節のみ)) を対象とする。
がん組織検体を治療前の生検時と手術検体から採取し、血液検体を治療前、NAC 後、術後1ヶ月、
術後3ヶ月、術後6ヶ月の時点で採取する。組織検体(生検または手術検体)と血液検体の解析
を行い、組織と血液のデータを照合することで血中循環腫瘍 DNA (circulating tumor DNA,ctDNA)
を検出し評価する。主要評価項目として、手術後 ctDNA(-)群の 1 年無再発生存割合を評価する。
(効果)
AVENIO ctDNA Assay System は血液中の遺伝子変異を検出し、がんに関連する 77 遺伝子の異常
を検出する臨床検査である。あらかじめ食道癌原発巣に存在する変異遺伝子を同定し、AVENIO
ctDNA Expanded kit によって検出された血液中の遺伝子変異を照合することで、ctDNA の評価が
可能となる。そして、手術後の ctDNA の陽性、陰性を主軸に、病理組織学的診断、画像診断など
を総合的に判断し、術後再発リスクを判定する。術後再発リスクにもとづき、術後補助化学療法
の必要性を検討する。
なお本邦では、食道癌の手術後において、免疫チェックポイント阻害剤であるニボルマブにつ
7