よむ、つかう、まなぶ。
資料2-1 令和5年度の安全対策について[850KB] (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40727.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第1回 6/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
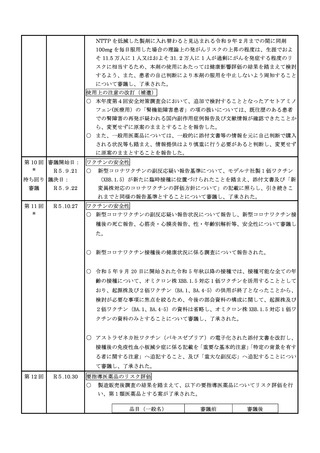
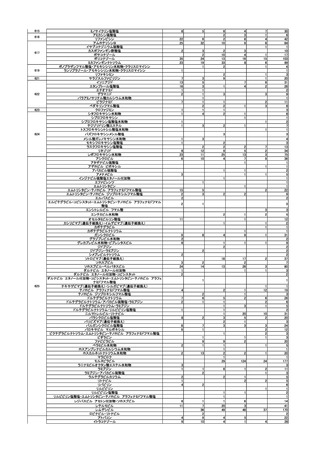
状況を報告した。
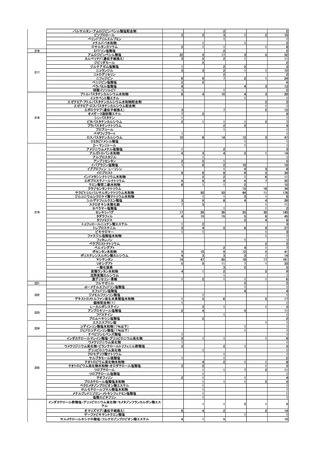
(2)安全対策調査会
回数
開催日
第1回※
R5.4.28
開催結果概要
ワクチンの安全性
○ 新型コロナワクチンの副反応疑い報告状況について報告し、新型コロナワクチン接
種後の死亡報告、心筋炎・心膜炎報告、性・年齢別解析等、安全性について審議し
た。
○ 新型コロナワクチン接種後の健康状況に係る調査について報告された。
○ 新型コロナワクチン接種後の遷延する症状に関する実態調査について報告された。
○ 令和4年 10 月1日から令和4年 12 月 31 日までの麻しん、風しん、おたふくか
ぜ、水痘、帯状疱疹、肺炎球菌(23 価)、HPV、百日せき、ジフテリア、破傷風、
不活化ポリオ、肺炎球菌(13 価)、Hib、BCG、日本脳炎、ロタウイルス、インフル
エンザのワクチンの副反応が疑われる症例の報告状況について審議した。
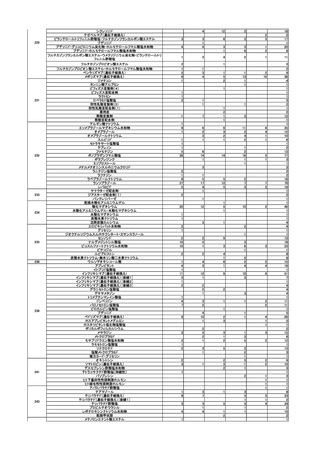
第2回
R5.5.10
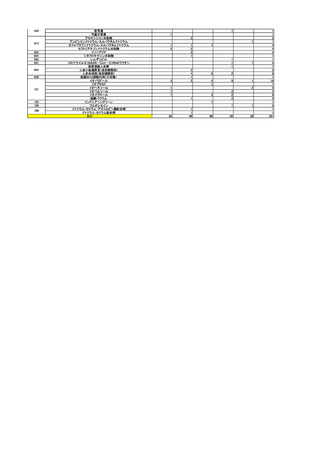
一般用医薬品のリスク区分
○
製造販売後調査の結果を踏まえて、以下の一般用医薬品についてリスク区分の検
討を行い、指定第2類医薬品とする案が了承された。
品目(一般名)
審議前
審議後
フルチカゾンプロピオン酸
エステル
第1類
指定第2類
緊急承認された医薬品の市販後安全対策
○ ゾコーバ錠の副作用等の報告状況及び添付文書に避妊期間が追記されたことを報告
し、ゾコーバ錠の追加の安全対策の要否について審議した。
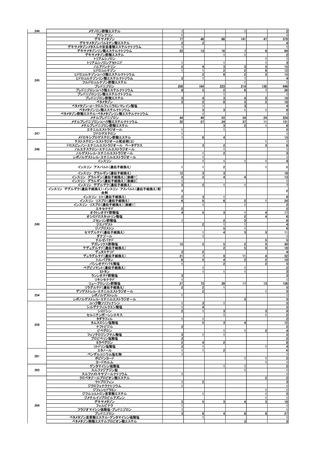
第3回
R5.6.7
緊急承認された医薬品の市販後安全対策
○ ゾコーバ錠の副作用等の報告状況、市販直後調査終了に伴う製造販売業者の今
後の対応について報告し、ゾコーバ錠の追加の安全対策の要否について審議し
た。
ノルトリプチリン塩酸塩製剤におけるニトロソアミン類の検出への対応について
○ ノルトリプチリン塩酸塩製剤から N-ニトロソノルトリプチリンが検出され、本
剤 150mg を毎日服用し、その投与期間は通常 10 年を超えないと仮定した場合の理
論上の発がんリスクの上昇の程度は生涯で 2.3 万人に 1 人が過剰にがんを発症する
程度のリスクに相当するため、当面の対応として、本剤の使用による健康影響評価
の結果を情報提供したうえで、医療現場において他剤への切替え等を検討するよう
周知することについて審議し、了承された。
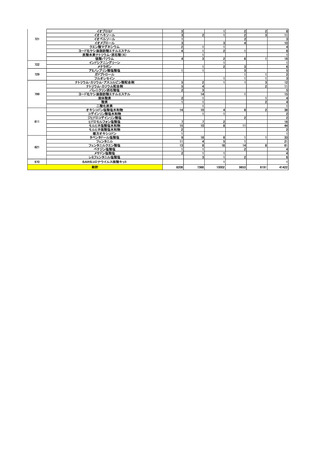
4
(2)安全対策調査会
回数
開催日
第1回※
R5.4.28
開催結果概要
ワクチンの安全性
○ 新型コロナワクチンの副反応疑い報告状況について報告し、新型コロナワクチン接
種後の死亡報告、心筋炎・心膜炎報告、性・年齢別解析等、安全性について審議し
た。
○ 新型コロナワクチン接種後の健康状況に係る調査について報告された。
○ 新型コロナワクチン接種後の遷延する症状に関する実態調査について報告された。
○ 令和4年 10 月1日から令和4年 12 月 31 日までの麻しん、風しん、おたふくか
ぜ、水痘、帯状疱疹、肺炎球菌(23 価)、HPV、百日せき、ジフテリア、破傷風、
不活化ポリオ、肺炎球菌(13 価)、Hib、BCG、日本脳炎、ロタウイルス、インフル
エンザのワクチンの副反応が疑われる症例の報告状況について審議した。
第2回
R5.5.10
一般用医薬品のリスク区分
○
製造販売後調査の結果を踏まえて、以下の一般用医薬品についてリスク区分の検
討を行い、指定第2類医薬品とする案が了承された。
品目(一般名)
審議前
審議後
フルチカゾンプロピオン酸
エステル
第1類
指定第2類
緊急承認された医薬品の市販後安全対策
○ ゾコーバ錠の副作用等の報告状況及び添付文書に避妊期間が追記されたことを報告
し、ゾコーバ錠の追加の安全対策の要否について審議した。
第3回
R5.6.7
緊急承認された医薬品の市販後安全対策
○ ゾコーバ錠の副作用等の報告状況、市販直後調査終了に伴う製造販売業者の今
後の対応について報告し、ゾコーバ錠の追加の安全対策の要否について審議し
た。
ノルトリプチリン塩酸塩製剤におけるニトロソアミン類の検出への対応について
○ ノルトリプチリン塩酸塩製剤から N-ニトロソノルトリプチリンが検出され、本
剤 150mg を毎日服用し、その投与期間は通常 10 年を超えないと仮定した場合の理
論上の発がんリスクの上昇の程度は生涯で 2.3 万人に 1 人が過剰にがんを発症する
程度のリスクに相当するため、当面の対応として、本剤の使用による健康影響評価
の結果を情報提供したうえで、医療現場において他剤への切替え等を検討するよう
周知することについて審議し、了承された。
4