よむ、つかう、まなぶ。
資料2-1 令和5年度の安全対策について[850KB] (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40727.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第1回 6/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
第4回
R5.7.25
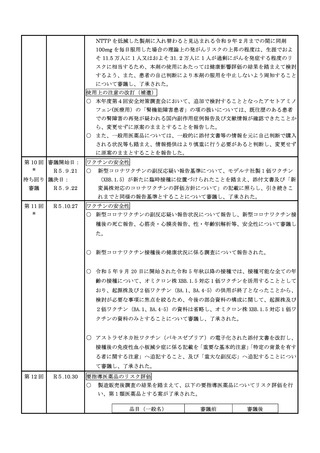
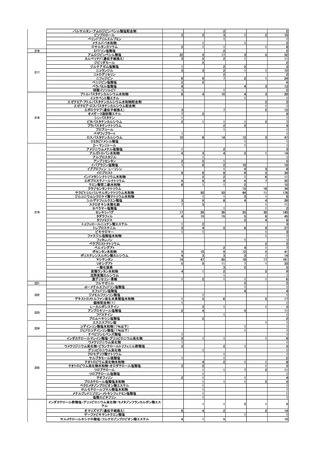
使用上の注意の改訂
○
アセトアミノフェン含有製剤(医療用)の電子化された添付文書について、以下
の使用上の注意の改訂案が了承された。
・ 「消化性潰瘍のある患者、重篤な血液の異常のある患者、重篤な心機能不全のある
患者」を「禁忌」の項から削除し「合併症・既往歴等のある患者」に設定する。
・ 「重篤な腎障害のある患者」を「禁忌」の項から削除し「腎機能障害患者」の項に
本剤の投与量及び投与間隔の調節を考慮する旨の注意喚起を追記する。
・ アセトアミノフェン単剤及びジプロフィリン・アセトアミノフェン等配合剤では、
「アスピリン喘息(非ステロイド性消炎鎮痛剤による喘息発作の誘発)又はその既
往歴のある患者」を「禁忌」の項から削除し「合併症・既往歴等のある患者」の項
に設定するとともに、「用法及び用量に関連する注意」の項にアスピリン喘息又は
その既往歴のある患者に対する 1 回あたりの最大用量はアセトアミノフェンとし
て 300 mg 以下とする旨の注意喚起を追記する。
・ トラマドール塩酸塩・アセトアミノフェン配合剤では、「アスピリン喘息(非ステ
ロイド性消炎鎮痛剤による喘息発作の誘発)又はその既往歴のある患者」を「抜歯
後の疼痛」の効能に対しては引き続き禁忌とし、「非がん性慢性疼痛」の効能に対
しては「禁忌」の項から削除し「合併症・既往歴等のある患者」の項にアスピリン
喘息又はその既往歴のある患者には本剤を用いず個別のアセトアミノフェン製剤を
用いた用量調節を考慮する旨の注意を追記するとともに、「用法及び用量に関連す
る注意」の項に 1 回 1 錠とする旨の注意喚起を追記する。
○
また、「腎機能障害患者」の項の「腎障害又は既往歴のある患者」を「腎障害の
患者」へ変更する必要性を追加で検討することとなった。また、アセトアミノフ
ェンを含有する一般用医薬品については、情報を整理した上で改訂の要否を検討
し後日報告することとなった。
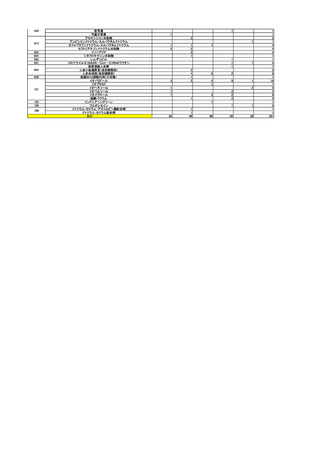
要指導医薬品のリスク評価
○
製造販売後調査の結果を踏まえて、以下の要指導医薬品についてリスク評価を行
い、第1類医薬品とする案が了承された。
品目(一般名)
審議前
審議後
精製ヒアルロン酸ナトリウ
ム
要指導
第1類
緊急承認された医薬品の市販後安全対策
○ ゾコーバ錠の使用上の注意にアナフィラキシーの追記を指示したなどの追加の
安全対策の実施に関して報告した。
第5回※
R5.7.28
ワクチンの安全性
○ 新型コロナワクチンの副反応疑い報告状況について報告し、新型コロナワクチン接
種後の死亡報告、心筋炎・心膜炎報告、性・年齢別解析等、安全性について審議し
た。
○ 新型コロナワクチン接種後の健康状況に係る調査について報告された。
5
R5.7.25
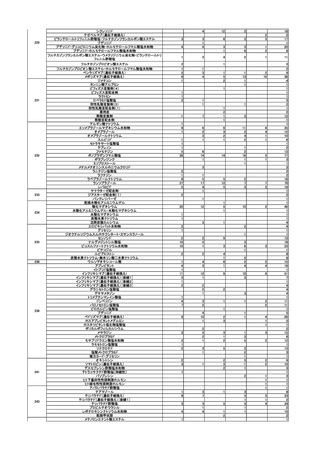
使用上の注意の改訂
○
アセトアミノフェン含有製剤(医療用)の電子化された添付文書について、以下
の使用上の注意の改訂案が了承された。
・ 「消化性潰瘍のある患者、重篤な血液の異常のある患者、重篤な心機能不全のある
患者」を「禁忌」の項から削除し「合併症・既往歴等のある患者」に設定する。
・ 「重篤な腎障害のある患者」を「禁忌」の項から削除し「腎機能障害患者」の項に
本剤の投与量及び投与間隔の調節を考慮する旨の注意喚起を追記する。
・ アセトアミノフェン単剤及びジプロフィリン・アセトアミノフェン等配合剤では、
「アスピリン喘息(非ステロイド性消炎鎮痛剤による喘息発作の誘発)又はその既
往歴のある患者」を「禁忌」の項から削除し「合併症・既往歴等のある患者」の項
に設定するとともに、「用法及び用量に関連する注意」の項にアスピリン喘息又は
その既往歴のある患者に対する 1 回あたりの最大用量はアセトアミノフェンとし
て 300 mg 以下とする旨の注意喚起を追記する。
・ トラマドール塩酸塩・アセトアミノフェン配合剤では、「アスピリン喘息(非ステ
ロイド性消炎鎮痛剤による喘息発作の誘発)又はその既往歴のある患者」を「抜歯
後の疼痛」の効能に対しては引き続き禁忌とし、「非がん性慢性疼痛」の効能に対
しては「禁忌」の項から削除し「合併症・既往歴等のある患者」の項にアスピリン
喘息又はその既往歴のある患者には本剤を用いず個別のアセトアミノフェン製剤を
用いた用量調節を考慮する旨の注意を追記するとともに、「用法及び用量に関連す
る注意」の項に 1 回 1 錠とする旨の注意喚起を追記する。
○
また、「腎機能障害患者」の項の「腎障害又は既往歴のある患者」を「腎障害の
患者」へ変更する必要性を追加で検討することとなった。また、アセトアミノフ
ェンを含有する一般用医薬品については、情報を整理した上で改訂の要否を検討
し後日報告することとなった。
要指導医薬品のリスク評価
○
製造販売後調査の結果を踏まえて、以下の要指導医薬品についてリスク評価を行
い、第1類医薬品とする案が了承された。
品目(一般名)
審議前
審議後
精製ヒアルロン酸ナトリウ
ム
要指導
第1類
緊急承認された医薬品の市販後安全対策
○ ゾコーバ錠の使用上の注意にアナフィラキシーの追記を指示したなどの追加の
安全対策の実施に関して報告した。
第5回※
R5.7.28
ワクチンの安全性
○ 新型コロナワクチンの副反応疑い報告状況について報告し、新型コロナワクチン接
種後の死亡報告、心筋炎・心膜炎報告、性・年齢別解析等、安全性について審議し
た。
○ 新型コロナワクチン接種後の健康状況に係る調査について報告された。
5