よむ、つかう、まなぶ。
資料2-1 令和5年度の安全対策について[850KB] (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40727.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第1回 6/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
ベポタスチンベシル酸塩
要指導
第1類
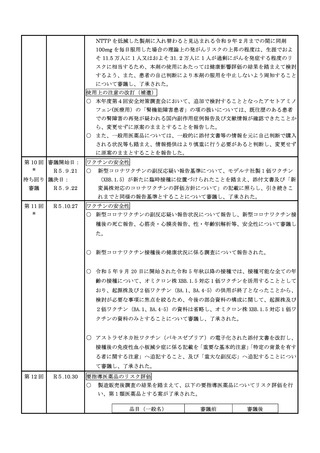
緊急承認された医薬品の市販後安全対策
○ ゾコーバ錠の副作用等の報告状況及び妊婦投与事例を踏まえ厚生労働省や製造
販売業者が、国民向けに薬の服用時の妊娠の可能性の確認の重要性や併用薬の
服用に関する確認の重要性の周知を継続することについて報告し、ゾコーバ錠
の追加の安全対策の要否について審議した。
第 13 回 審議開始日:
※
R5.11.30
持ち回り 議決日:
審議
R5.12.1
ワクチンの安全性
○ 新型コロナワクチンの副反応疑い報告基準について、第一三共社製オミクロン株対
応1価ワクチン(XBB.1.5)が新たに臨時接種に位置づけられたことを踏まえ、副
反応疑い報告基準については、添付文書及び審査報告書の記載に照らし、同一モダ
リティ mRNA ワクチンであるファイザー社製既承認ワクチン及びモデルナ社製既承
認ワクチンに係る報告基準と同様の報告基準とすることについて審議し、了承され
た。
第 14 回
R6.1.23
緊急承認された医薬品の市販後安全対策
○ ゾコーバ錠の副作用等の報告状況、妊婦投与事例及び肝機能障害を有する被験
者を対象とした臨床薬理試験の結果概要について報告し、ゾコーバ錠の追加の
安全対策の要否について審議した。
第 15 回
※
R6.1.26
ワクチンの安全性
○ 新型コロナワクチンの副反応疑い報告状況について報告し、新型コロナワクチン接
種後の死亡報告、心筋炎・心膜炎報告、性・年齢別解析等、安全性について審議し
た。
○ 新型コロナワクチン接種後の健康状況に係る調査について報告された。
○ 新型コロナワクチン接種後の遷延する症状に関する実態調査について報告された。
○ 令和5年 7 月1日から令和5年 9 月 31 日までの麻しん、風しん、おたふくかぜ、水
痘、帯状疱疹、肺炎球菌(23 価)、HPV、百日せき、ジフテリア、破傷風、不活化ポ
リオ、肺炎球菌(13 価)、肺炎球菌(15 価)、Hib、BCG、日本脳炎、ロタウイルスの
ワクチンの副反応が疑われる症例の報告状況について審議した。
○ 新たに定期接種に位置づけられるワクチンに係る副反応疑い報告基準のうち、
・5 種混合ワクチンについては、現行の 4 種混合ワクチンには、Hib ワクチンによる
副反応報告基準が既に含まれていることから、4 種混合ワクチンに係る副反応疑い
報告基準を適用すること
・小児に対する肺炎球菌ワクチン(PCV15)については、引き続き PCV13 と同様の副
反応疑い報告基準を適用すること
8
要指導
第1類
緊急承認された医薬品の市販後安全対策
○ ゾコーバ錠の副作用等の報告状況及び妊婦投与事例を踏まえ厚生労働省や製造
販売業者が、国民向けに薬の服用時の妊娠の可能性の確認の重要性や併用薬の
服用に関する確認の重要性の周知を継続することについて報告し、ゾコーバ錠
の追加の安全対策の要否について審議した。
第 13 回 審議開始日:
※
R5.11.30
持ち回り 議決日:
審議
R5.12.1
ワクチンの安全性
○ 新型コロナワクチンの副反応疑い報告基準について、第一三共社製オミクロン株対
応1価ワクチン(XBB.1.5)が新たに臨時接種に位置づけられたことを踏まえ、副
反応疑い報告基準については、添付文書及び審査報告書の記載に照らし、同一モダ
リティ mRNA ワクチンであるファイザー社製既承認ワクチン及びモデルナ社製既承
認ワクチンに係る報告基準と同様の報告基準とすることについて審議し、了承され
た。
第 14 回
R6.1.23
緊急承認された医薬品の市販後安全対策
○ ゾコーバ錠の副作用等の報告状況、妊婦投与事例及び肝機能障害を有する被験
者を対象とした臨床薬理試験の結果概要について報告し、ゾコーバ錠の追加の
安全対策の要否について審議した。
第 15 回
※
R6.1.26
ワクチンの安全性
○ 新型コロナワクチンの副反応疑い報告状況について報告し、新型コロナワクチン接
種後の死亡報告、心筋炎・心膜炎報告、性・年齢別解析等、安全性について審議し
た。
○ 新型コロナワクチン接種後の健康状況に係る調査について報告された。
○ 新型コロナワクチン接種後の遷延する症状に関する実態調査について報告された。
○ 令和5年 7 月1日から令和5年 9 月 31 日までの麻しん、風しん、おたふくかぜ、水
痘、帯状疱疹、肺炎球菌(23 価)、HPV、百日せき、ジフテリア、破傷風、不活化ポ
リオ、肺炎球菌(13 価)、肺炎球菌(15 価)、Hib、BCG、日本脳炎、ロタウイルスの
ワクチンの副反応が疑われる症例の報告状況について審議した。
○ 新たに定期接種に位置づけられるワクチンに係る副反応疑い報告基準のうち、
・5 種混合ワクチンについては、現行の 4 種混合ワクチンには、Hib ワクチンによる
副反応報告基準が既に含まれていることから、4 種混合ワクチンに係る副反応疑い
報告基準を適用すること
・小児に対する肺炎球菌ワクチン(PCV15)については、引き続き PCV13 と同様の副
反応疑い報告基準を適用すること
8