よむ、つかう、まなぶ。
資料2-1 令和5年度の安全対策について[850KB] (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40727.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第1回 6/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
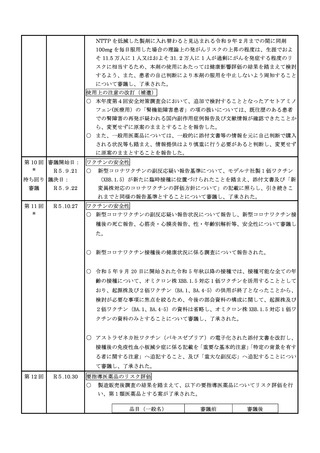
○ 新型コロナワクチン接種後の遷延する症状に関する実態調査について報告された。
○ 令和 5 年 1 月1日から令和 5 年 3 月 31 日までの麻しん、風しん、おたふくかぜ、
水痘、帯状疱疹、肺炎球菌(23 価)、HPV、百日せき、ジフテリア、破傷風、不活
化ポリオ、肺炎球菌(13 価)、Hib、BCG、日本脳炎、ロタウイルスのワクチン及び
令和 4 年 10 月 1 日から令和 5 年 3 月 31 日までのインフルエンザワクチンの副反応
が疑われる症例の報告状況について審議した。
第6回
R5.8.30
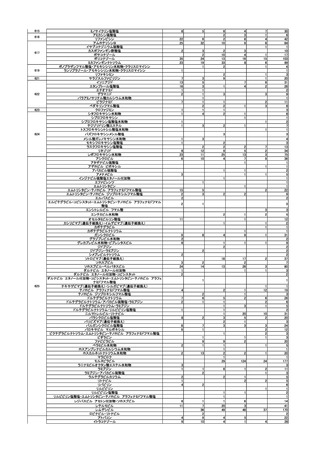
一般用医薬品のリスク区分
○
製造販売後調査の結果を踏まえて、以下の一般用医薬品についてリスク区分の検
討を行い、第1類医薬品とする案が了承された。
品目(一般名)
イソコナゾール
(一錠中イソコナゾール硝
酸塩として 0.6gを含有す
るものに限る。)
審議前
審議後
第1類
第1類
緊急承認された医薬品の市販後安全対策
○ ゾコーバ錠の副作用等の報告状況及び妊婦投与事例を踏まえ厚生労働省から国民向
けに薬の服用時の妊娠の可能性の確認の重要性を X や厚労省 HP による周知を継続
することを報告したところ、併用禁忌の薬との併用例が報告されたことから、製造
販売業者から併用薬の服用に関する確認の重要性の周知を行うこととされた。
第7回
R5.9.1
予防接種データベースについて
○ 予防接種データベースに関して、ワクチンの安全性評価及び副反応疑い報告の現状
を踏まえ、予防接種デジタル化後のワクチンの安全性評価及び副反応疑い報告の方
向性について審議し、了承された。
第8回※ 審議開始日:
持ち回り
審議
R5.9.14
議決日:
R5.9.15
ワクチンの安全性
○ 新型コロナワクチンの副反応疑い報告基準について、ファイザー社製1価ワクチン
(XBB.1.5)(12 歳以上用、5~11 歳用、6 ヶ月~4 歳用)が新たに臨時接種に位置
づけられたことを踏まえ、添付文書及び「新変異株対応のコロナワクチンの評価方
針について」の記載に照らし、引き続きこれまでと同様の報告基準とすることにつ
いて審議し、了承された。
第9回
R5.9.21
ニトロソアミン類の混入による健康影響評価について
○ 毒性データが十分にないニトロソアミン類の1日許容摂取量を設定する手法とし
て、欧州医薬品庁が公表した「Carcinogenic Potency Categorization Approach
for N-nitrosamines」を、国内においても使用して差し支えない旨を周知したこと
を報告した。
○ シタグリプチンリン酸塩水和物含有製剤から検出されたニトロソアミン類
(NTTP)について、製造販売業者が実施した非臨床試験結果から発がん性が示唆
され、シタグリプチン単剤で NTTP の 1 日許容摂取量(37ng 又は 100ng)を上
回るロットが認められたことから、製造販売承認取得から国内流通の全製剤が
6
○ 令和 5 年 1 月1日から令和 5 年 3 月 31 日までの麻しん、風しん、おたふくかぜ、
水痘、帯状疱疹、肺炎球菌(23 価)、HPV、百日せき、ジフテリア、破傷風、不活
化ポリオ、肺炎球菌(13 価)、Hib、BCG、日本脳炎、ロタウイルスのワクチン及び
令和 4 年 10 月 1 日から令和 5 年 3 月 31 日までのインフルエンザワクチンの副反応
が疑われる症例の報告状況について審議した。
第6回
R5.8.30
一般用医薬品のリスク区分
○
製造販売後調査の結果を踏まえて、以下の一般用医薬品についてリスク区分の検
討を行い、第1類医薬品とする案が了承された。
品目(一般名)
イソコナゾール
(一錠中イソコナゾール硝
酸塩として 0.6gを含有す
るものに限る。)
審議前
審議後
第1類
第1類
緊急承認された医薬品の市販後安全対策
○ ゾコーバ錠の副作用等の報告状況及び妊婦投与事例を踏まえ厚生労働省から国民向
けに薬の服用時の妊娠の可能性の確認の重要性を X や厚労省 HP による周知を継続
することを報告したところ、併用禁忌の薬との併用例が報告されたことから、製造
販売業者から併用薬の服用に関する確認の重要性の周知を行うこととされた。
第7回
R5.9.1
予防接種データベースについて
○ 予防接種データベースに関して、ワクチンの安全性評価及び副反応疑い報告の現状
を踏まえ、予防接種デジタル化後のワクチンの安全性評価及び副反応疑い報告の方
向性について審議し、了承された。
第8回※ 審議開始日:
持ち回り
審議
R5.9.14
議決日:
R5.9.15
ワクチンの安全性
○ 新型コロナワクチンの副反応疑い報告基準について、ファイザー社製1価ワクチン
(XBB.1.5)(12 歳以上用、5~11 歳用、6 ヶ月~4 歳用)が新たに臨時接種に位置
づけられたことを踏まえ、添付文書及び「新変異株対応のコロナワクチンの評価方
針について」の記載に照らし、引き続きこれまでと同様の報告基準とすることにつ
いて審議し、了承された。
第9回
R5.9.21
ニトロソアミン類の混入による健康影響評価について
○ 毒性データが十分にないニトロソアミン類の1日許容摂取量を設定する手法とし
て、欧州医薬品庁が公表した「Carcinogenic Potency Categorization Approach
for N-nitrosamines」を、国内においても使用して差し支えない旨を周知したこと
を報告した。
○ シタグリプチンリン酸塩水和物含有製剤から検出されたニトロソアミン類
(NTTP)について、製造販売業者が実施した非臨床試験結果から発がん性が示唆
され、シタグリプチン単剤で NTTP の 1 日許容摂取量(37ng 又は 100ng)を上
回るロットが認められたことから、製造販売承認取得から国内流通の全製剤が
6