よむ、つかう、まなぶ。
【資料1】スイッチOTC WGからの報告について[665KB] (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_42640.html |
| 出典情報 | 薬事審議会 要指導・一般用医薬品部会(令和6年度第2回 9/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
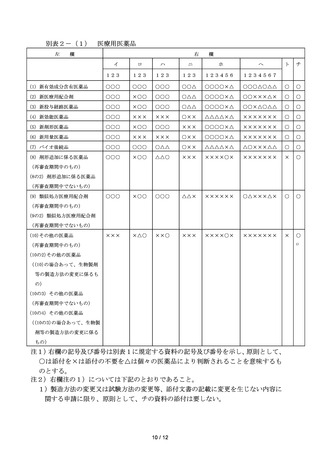
別表2-(2)
左
要指導・一般用医薬品
欄
右
欄
イ
ロ
ハ
ニ
ホ
ヘ
ト
チ
123
123
123
123
123456
1234567
(1) 新有効成分含有医薬品
○○○
○○○
○○○
○○△
○○○○×△
○○○△○△△
○
○
(2) 新投与経路医薬品
○○○
×○○
○○○
○△△
○○○○×△
○○×△○△△
○
○
(3)-① 新効能医薬品
○○○
×××
×××
○××
△△△△×△
×××××××
○
○
(3)-② 新剤形医薬品
○○○
×○○
○○○
×××
○○○○×△
×××××××
○
○
(3)-③ 新用量医薬品
○○○
×××
×××
×××
○○○○×△
×××××××
○
○
(4) 要指導(一般用)新有効成
○○○
××○
△×△2)
×××
△×××××
△△×××△△
○
○
○○○
××○
△×△2)
×××
△×××××
△△×××△△
○
○
○○○
×××
×××
×××
△×××××
×××××××
○
○
○○○
××○
△×△2)
×××
△×××××
×××××××
○
○
○○○
×××
×××
×××
△×××××
×××××××
○
○
(6) 一般用(要指導)新配合剤
○○○
××○
△×△2)
×××
△×××××
△△×××△×
○
○
(7)-① 類似処方一般用配合剤
××○
××○
△×△2)
×××
△×××××
△△×××××
×
○
(7)-② 類似剤形一般用医薬品
××○
××○
△×△2)
×××
△×××××
×××××××
×
○
(8) その他の一般用医薬品
××○1)
××○
△×△2)
×××
××××××
×××××××
×
×
分含有医薬品
(5)-① 要指導(一般用)新投
与経路医薬品
(5)-② 要指導(一般用)新効
能医薬品
(5)-③ 一般用(要指導)新剤
形医薬品
(5)-④ 一般用(要指導)新用
量医薬品
(承認基準品目等)
注1)右欄の記号及び番号は別表1に規定する資料の記号及び番号を示し、原則として、
○は添付を×は添付の不要を△は個々の医薬品により判断されることを意味するも
のとする。
注2)右欄注の1)から2)については下記のとおりであること。
1) 承認基準に適合する医薬品については、承認基準と申請品目の有効成分及びそ
の分量に関する対比表を添付することでよい。承認基準に適合する医薬品以外につ
いては、処方設計の根拠及び有効性・安全性等について十分説明すること。
2)加速試験により3年以上の安定性が推定されないものについては長期保存試験成
績が必要である。
ただし、申請時において長期保存試験により、暫定的に1年以上の有効期間を設
定できるものについては、長期保存試験の途中であっても承認申請して差し支えな
いこと。その場合、申請者は、承認時までにその後引き続き試験した長期保存試験
の成績を提出するものとする。
11 / 12
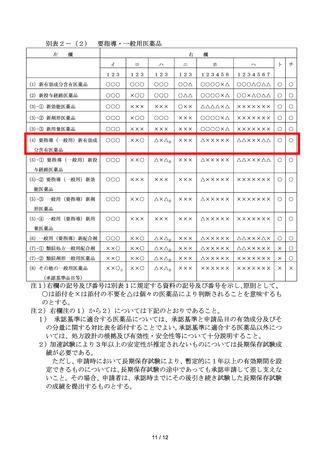
左
要指導・一般用医薬品
欄
右
欄
イ
ロ
ハ
ニ
ホ
ヘ
ト
チ
123
123
123
123
123456
1234567
(1) 新有効成分含有医薬品
○○○
○○○
○○○
○○△
○○○○×△
○○○△○△△
○
○
(2) 新投与経路医薬品
○○○
×○○
○○○
○△△
○○○○×△
○○×△○△△
○
○
(3)-① 新効能医薬品
○○○
×××
×××
○××
△△△△×△
×××××××
○
○
(3)-② 新剤形医薬品
○○○
×○○
○○○
×××
○○○○×△
×××××××
○
○
(3)-③ 新用量医薬品
○○○
×××
×××
×××
○○○○×△
×××××××
○
○
(4) 要指導(一般用)新有効成
○○○
××○
△×△2)
×××
△×××××
△△×××△△
○
○
○○○
××○
△×△2)
×××
△×××××
△△×××△△
○
○
○○○
×××
×××
×××
△×××××
×××××××
○
○
○○○
××○
△×△2)
×××
△×××××
×××××××
○
○
○○○
×××
×××
×××
△×××××
×××××××
○
○
(6) 一般用(要指導)新配合剤
○○○
××○
△×△2)
×××
△×××××
△△×××△×
○
○
(7)-① 類似処方一般用配合剤
××○
××○
△×△2)
×××
△×××××
△△×××××
×
○
(7)-② 類似剤形一般用医薬品
××○
××○
△×△2)
×××
△×××××
×××××××
×
○
(8) その他の一般用医薬品
××○1)
××○
△×△2)
×××
××××××
×××××××
×
×
分含有医薬品
(5)-① 要指導(一般用)新投
与経路医薬品
(5)-② 要指導(一般用)新効
能医薬品
(5)-③ 一般用(要指導)新剤
形医薬品
(5)-④ 一般用(要指導)新用
量医薬品
(承認基準品目等)
注1)右欄の記号及び番号は別表1に規定する資料の記号及び番号を示し、原則として、
○は添付を×は添付の不要を△は個々の医薬品により判断されることを意味するも
のとする。
注2)右欄注の1)から2)については下記のとおりであること。
1) 承認基準に適合する医薬品については、承認基準と申請品目の有効成分及びそ
の分量に関する対比表を添付することでよい。承認基準に適合する医薬品以外につ
いては、処方設計の根拠及び有効性・安全性等について十分説明すること。
2)加速試験により3年以上の安定性が推定されないものについては長期保存試験成
績が必要である。
ただし、申請時において長期保存試験により、暫定的に1年以上の有効期間を設
定できるものについては、長期保存試験の途中であっても承認申請して差し支えな
いこと。その場合、申請者は、承認時までにその後引き続き試験した長期保存試験
の成績を提出するものとする。
11 / 12