よむ、つかう、まなぶ。
【資料1】スイッチOTC WGからの報告について[665KB] (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_42640.html |
| 出典情報 | 薬事審議会 要指導・一般用医薬品部会(令和6年度第2回 9/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
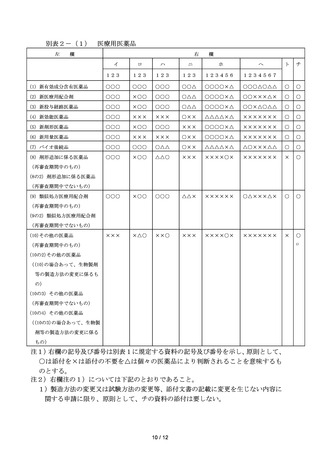
らカの医薬品は、一般用(要指導)新配合剤に該当する。
(22)類似処方一般用配合剤とは、既承認一般用医薬品の有効成分として含有さ
れている成分からなる医薬品であって、既承認一般用医薬品と有効成分の組
合せが類似処方の一般用医薬品をいう。
(23)類似剤形一般用医薬品とは、新剤形医薬品以外であって、既承認一般用医
薬品と有効成分、投与経路及び効能・効果は同一であるが、剤形が異なる一
般用医薬品のうち、(19)に該当しないものをいう。
(24)その他の一般用医薬品とは、一般用医薬品であって、(1)から(23)に
該当しないものをいう。
第2
1
承認申請書に添付すべき資料
承認申請書に添付すべき資料を作成するための試験は、医薬品の安全性に関
する非臨床試験の実施の基準(GLP)、医薬品の臨床試験の実施の基準(GCP)
及び申請資料の信頼性の基準を遵守するとともに、十分な設備のある施設にお
いて、経験のある研究者により、その時点における医学薬学等の学問水準に基
づき、適正に実施されたものでなければならない。
2 承認申請書に添付すべき資料は、原則として邦文で記載されたものでなけれ
ばならない。ただし、原文が英文で記載されたものであれば、その原文及び日
本語要約を提出することで差し支えない。
3 承認申請書に添付すべき資料の編集方法及び当該資料を作成するための試
験の指針は、必要に応じ別途定めるものとする。
4 薬事法等の一部を改正する法律及び薬事法等の一部を改正する法律の施行
に伴う関係政令の整備等及び経過措置に関する政令の施行に伴う関係省令の
整備等に関する省令(平成 26 年厚生労働省令第 87 号)による改正後の医薬品、
医療機器等の品質、有効性及び安全性の確保等に関する法律施行規則(昭和
36 年厚生省令第1号)第 40 条第1項第1号に列記されている資料の内容は、
概ね別表1の右欄に掲げる資料とする。
5 承認申請書に添付すべき資料の範囲は、原則として別表2左欄の区分に従い、
同表右欄に示す資料とする。
この場合において分類区分を判定し難い場合には、資料要求数が多い区分に
よることとし、二以上の区分にまたがる場合には、各々の区分において必要と
される資料を必要とする。ただし、資料作成のための試験が技術的に実施不可
能な場合及び当該医薬品の種類、用法等からみて実施する意味がないと考えら
れる場合は、当該資料の添付を要しない。
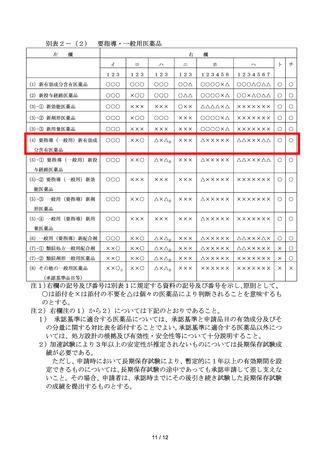
6 別表2-(1)の(1)から(9の2)に該当する医薬品及び別表2-(2)
の(1)から(7)-②に該当する医薬品にあっては、添付した資料の内容を
適確かつ簡潔にまとめ、また、効能・効果、用法・用量、使用上の注意の案及
びそれらの設定理由に関する情報を盛り込んだ資料概要を提出するものとす
7 / 12
(22)類似処方一般用配合剤とは、既承認一般用医薬品の有効成分として含有さ
れている成分からなる医薬品であって、既承認一般用医薬品と有効成分の組
合せが類似処方の一般用医薬品をいう。
(23)類似剤形一般用医薬品とは、新剤形医薬品以外であって、既承認一般用医
薬品と有効成分、投与経路及び効能・効果は同一であるが、剤形が異なる一
般用医薬品のうち、(19)に該当しないものをいう。
(24)その他の一般用医薬品とは、一般用医薬品であって、(1)から(23)に
該当しないものをいう。
第2
1
承認申請書に添付すべき資料
承認申請書に添付すべき資料を作成するための試験は、医薬品の安全性に関
する非臨床試験の実施の基準(GLP)、医薬品の臨床試験の実施の基準(GCP)
及び申請資料の信頼性の基準を遵守するとともに、十分な設備のある施設にお
いて、経験のある研究者により、その時点における医学薬学等の学問水準に基
づき、適正に実施されたものでなければならない。
2 承認申請書に添付すべき資料は、原則として邦文で記載されたものでなけれ
ばならない。ただし、原文が英文で記載されたものであれば、その原文及び日
本語要約を提出することで差し支えない。
3 承認申請書に添付すべき資料の編集方法及び当該資料を作成するための試
験の指針は、必要に応じ別途定めるものとする。
4 薬事法等の一部を改正する法律及び薬事法等の一部を改正する法律の施行
に伴う関係政令の整備等及び経過措置に関する政令の施行に伴う関係省令の
整備等に関する省令(平成 26 年厚生労働省令第 87 号)による改正後の医薬品、
医療機器等の品質、有効性及び安全性の確保等に関する法律施行規則(昭和
36 年厚生省令第1号)第 40 条第1項第1号に列記されている資料の内容は、
概ね別表1の右欄に掲げる資料とする。
5 承認申請書に添付すべき資料の範囲は、原則として別表2左欄の区分に従い、
同表右欄に示す資料とする。
この場合において分類区分を判定し難い場合には、資料要求数が多い区分に
よることとし、二以上の区分にまたがる場合には、各々の区分において必要と
される資料を必要とする。ただし、資料作成のための試験が技術的に実施不可
能な場合及び当該医薬品の種類、用法等からみて実施する意味がないと考えら
れる場合は、当該資料の添付を要しない。
6 別表2-(1)の(1)から(9の2)に該当する医薬品及び別表2-(2)
の(1)から(7)-②に該当する医薬品にあっては、添付した資料の内容を
適確かつ簡潔にまとめ、また、効能・効果、用法・用量、使用上の注意の案及
びそれらの設定理由に関する情報を盛り込んだ資料概要を提出するものとす
7 / 12