よむ、つかう、まなぶ。
【資料1】スイッチOTC WGからの報告について[665KB] (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_42640.html |
| 出典情報 | 薬事審議会 要指導・一般用医薬品部会(令和6年度第2回 9/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
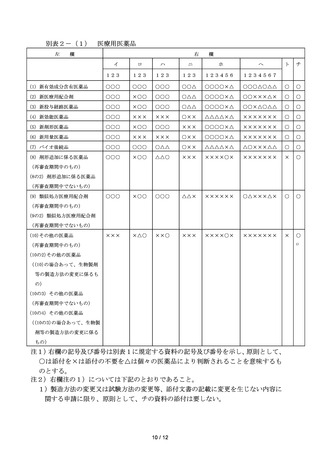
「これらの解析結果」及び「臨床試験は当該申請された効能又は効果、用法及び用量にお
ける有効性・安全性を確認する目的で実施されるものであること」を考慮すると、一定の範
囲でのスイッチ OTC に限っては、申請時の臨床試験結果の提出は必須ではないと考える。
上記整理を踏まえ、本 WG として、スイッチ OTC の審査に必要となる申請資料の内容の見
直しに関して、以下のとおり整理した。
〇
スイッチ OTC の申請において、①元となる医療用医薬品と生物学的同等性が確認されて
いる場合であり())
、また、②元となる医療用医薬品と同一成分及び分量並びに剤形で、
かつ、③効能又は効果が元となる医療用医薬品の承認事項の範囲内であり、各々の効能又
は効果について用法及び用量が元となる医療用医薬品の承認事項と同一であるスイッチ
OTC については、医療用医薬品の臨床試験結果の再解析やスイッチ OTC としての新たな臨
床試験を行うことなく、また医療用医薬品の臨床試験結果に関する承認申請資料を提出
することなく、スイッチ OTC の申請を行えることとすべきである。
)生物学的同等性については、現在でも、製剤が医療用医薬品と同一の場合は求めていない
ものの、同一でない場合は「後発医薬品の生物学的同等性試験ガイドライン等の一部改正に
ついて」
(令和 2 年 3 月 19 日付け薬生薬審発 0319 第1号厚生労働省医薬・生活衛生局医薬
品審査管理課長通知)等に準じて必要なデータ提出を求めている
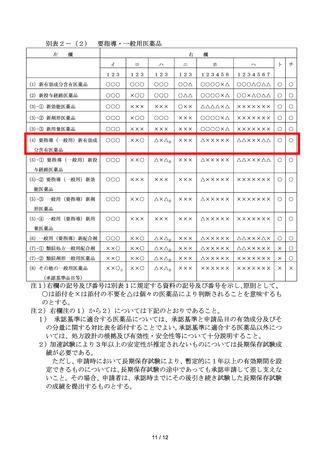
なお、スイッチ OTC は、承認当初は要指導医薬品として、その後は一般用医薬品として、
薬剤師その他の医薬関係者の確認・サポートの下、需要者の選択に基づき使用される点が医
療用医薬品とは異なることから、そのような状況でも、安全かつ適切に使用できるかが課題
となる。従来より、承認審査において、①薬局等での購入時に薬剤師から需要者へ行うスイ
ッチ OTC 医薬品の確認事項・指導内容の充実性、②適正使用を確保するための方策の適切性
の観点を含めた審査を行ってきたところであり、引き続き、この観点での審査を維持する。
〇 さらに、
「規制改革実施計画(令和6年6月 21 日)」
(閣議決定)において、スイッチ OTC
化の承認申請から承認の可否判断までの総期間を1年以内に設定すると定められたことを
確実に達成するためには、当局側及び申請企業側双方がそれに向けて努力を行う必要がある
ため、照会・回答に際して期限を設定する等、今後、詳細な標準的プロセスの検討を開始す
ることとする。更に、業界側では、各企業が適切な申請を行えるようにするための申請ガイ
ダンスを今後作成し、それに則した申請を実施するとともに、当局側では、PMDA において、
スイッチ OTC に関してその妥当性等を申請前から申請企業が判断しやすくするように、新た
な対面助言の枠組みを設置し、申請企業がその枠組みを十分活用することとする。なお、こ
の両者の取組は、定期的にフォローアップし、改善方策を両者で協議することとする。
4.製造販売後調査の実施
2
2 / 12
ける有効性・安全性を確認する目的で実施されるものであること」を考慮すると、一定の範
囲でのスイッチ OTC に限っては、申請時の臨床試験結果の提出は必須ではないと考える。
上記整理を踏まえ、本 WG として、スイッチ OTC の審査に必要となる申請資料の内容の見
直しに関して、以下のとおり整理した。
〇
スイッチ OTC の申請において、①元となる医療用医薬品と生物学的同等性が確認されて
いる場合であり())
、また、②元となる医療用医薬品と同一成分及び分量並びに剤形で、
かつ、③効能又は効果が元となる医療用医薬品の承認事項の範囲内であり、各々の効能又
は効果について用法及び用量が元となる医療用医薬品の承認事項と同一であるスイッチ
OTC については、医療用医薬品の臨床試験結果の再解析やスイッチ OTC としての新たな臨
床試験を行うことなく、また医療用医薬品の臨床試験結果に関する承認申請資料を提出
することなく、スイッチ OTC の申請を行えることとすべきである。
)生物学的同等性については、現在でも、製剤が医療用医薬品と同一の場合は求めていない
ものの、同一でない場合は「後発医薬品の生物学的同等性試験ガイドライン等の一部改正に
ついて」
(令和 2 年 3 月 19 日付け薬生薬審発 0319 第1号厚生労働省医薬・生活衛生局医薬
品審査管理課長通知)等に準じて必要なデータ提出を求めている
なお、スイッチ OTC は、承認当初は要指導医薬品として、その後は一般用医薬品として、
薬剤師その他の医薬関係者の確認・サポートの下、需要者の選択に基づき使用される点が医
療用医薬品とは異なることから、そのような状況でも、安全かつ適切に使用できるかが課題
となる。従来より、承認審査において、①薬局等での購入時に薬剤師から需要者へ行うスイ
ッチ OTC 医薬品の確認事項・指導内容の充実性、②適正使用を確保するための方策の適切性
の観点を含めた審査を行ってきたところであり、引き続き、この観点での審査を維持する。
〇 さらに、
「規制改革実施計画(令和6年6月 21 日)」
(閣議決定)において、スイッチ OTC
化の承認申請から承認の可否判断までの総期間を1年以内に設定すると定められたことを
確実に達成するためには、当局側及び申請企業側双方がそれに向けて努力を行う必要がある
ため、照会・回答に際して期限を設定する等、今後、詳細な標準的プロセスの検討を開始す
ることとする。更に、業界側では、各企業が適切な申請を行えるようにするための申請ガイ
ダンスを今後作成し、それに則した申請を実施するとともに、当局側では、PMDA において、
スイッチ OTC に関してその妥当性等を申請前から申請企業が判断しやすくするように、新た
な対面助言の枠組みを設置し、申請企業がその枠組みを十分活用することとする。なお、こ
の両者の取組は、定期的にフォローアップし、改善方策を両者で協議することとする。
4.製造販売後調査の実施
2
2 / 12