よむ、つかう、まなぶ。
【資料1】スイッチOTC WGからの報告について[665KB] (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_42640.html |
| 出典情報 | 薬事審議会 要指導・一般用医薬品部会(令和6年度第2回 9/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
る。なお、資料概要は、原則として邦文で記載されたものでなければならない。
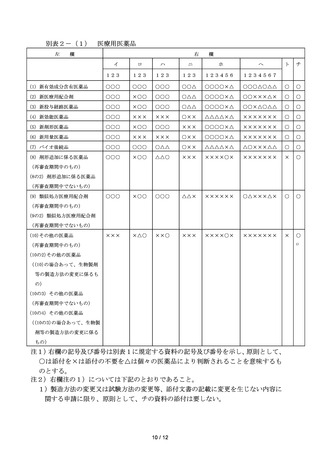
7 新医薬品とその成分・分量、用法・用量及び効能・効果が同一性を有すると
認められる医薬品を当該再審査期間中に申請する場合にあっては、当該新医薬
品と同等又はそれ以上の資料の添付を必要とする。
8 要指導・一般用医薬品であって、法第 79 条の規定に基づき使用時の安全性
に関する調査の実施を課せられている医薬品とその成分・分量、用法・用量及
び効能・効果が同一性を有すると認められる医薬品を当該調査期間中に申請
する場合にあっては、当該調査の実施を課せられている医薬品と同等又はそれ
以上の資料の添付を必要とする。
9 前記7又は8に該当する場合であっても、法第 14 条第9項に基づく承認事
項の一部変更承認申請の場合には、その事由により添付すべき資料の一部につ
いて添付を要しないものとすることができる。
10 既承認医薬品等の添加物として使用前例のない添加物を配合する場合又は
使用前例があっても投与経路が異なる若しくは前例を上回る量を使用する場
合には、当該添加物の品質、安全性等に関する資料を併せて提出することを必
要とする。
11 体外診断用医薬品の承認申請書に添付すべき資料については、昭和 60 年6
月 29 日付薬発第 662 号薬務局長通知「体外診断用医薬品の取扱いについて」
による。
12 専ら疾病の診断に使用されることが目的とされる医薬品であって人の皮膚
にはり付けられるもの及び殺虫剤又は殺菌消毒剤であって人体に直接使用し
ないものの承認申請書に添付すべき資料については、前記にかかわらず別途示
すこととする。
第3
1
通知の改正について
既存の通知等については、別途の通知等が発出されない限り、「薬事法」と
あるのは「医薬品医療機器等法」と、「一般用医薬品」とあるのは「要指導・
一般用医薬品」と読み替えるなど、必要な読替えを行った上で、引き続き適用
されるものであること。
2 通知等については、必要に応じ、改正後の法に対応した改正等も併せて行う
ものとする。
8 / 12
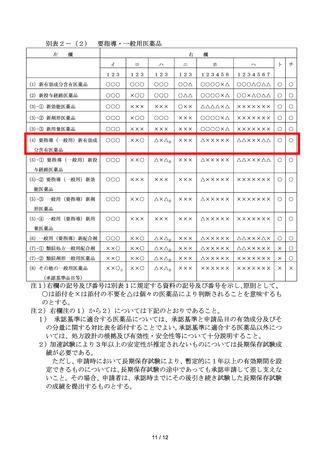
7 新医薬品とその成分・分量、用法・用量及び効能・効果が同一性を有すると
認められる医薬品を当該再審査期間中に申請する場合にあっては、当該新医薬
品と同等又はそれ以上の資料の添付を必要とする。
8 要指導・一般用医薬品であって、法第 79 条の規定に基づき使用時の安全性
に関する調査の実施を課せられている医薬品とその成分・分量、用法・用量及
び効能・効果が同一性を有すると認められる医薬品を当該調査期間中に申請
する場合にあっては、当該調査の実施を課せられている医薬品と同等又はそれ
以上の資料の添付を必要とする。
9 前記7又は8に該当する場合であっても、法第 14 条第9項に基づく承認事
項の一部変更承認申請の場合には、その事由により添付すべき資料の一部につ
いて添付を要しないものとすることができる。
10 既承認医薬品等の添加物として使用前例のない添加物を配合する場合又は
使用前例があっても投与経路が異なる若しくは前例を上回る量を使用する場
合には、当該添加物の品質、安全性等に関する資料を併せて提出することを必
要とする。
11 体外診断用医薬品の承認申請書に添付すべき資料については、昭和 60 年6
月 29 日付薬発第 662 号薬務局長通知「体外診断用医薬品の取扱いについて」
による。
12 専ら疾病の診断に使用されることが目的とされる医薬品であって人の皮膚
にはり付けられるもの及び殺虫剤又は殺菌消毒剤であって人体に直接使用し
ないものの承認申請書に添付すべき資料については、前記にかかわらず別途示
すこととする。
第3
1
通知の改正について
既存の通知等については、別途の通知等が発出されない限り、「薬事法」と
あるのは「医薬品医療機器等法」と、「一般用医薬品」とあるのは「要指導・
一般用医薬品」と読み替えるなど、必要な読替えを行った上で、引き続き適用
されるものであること。
2 通知等については、必要に応じ、改正後の法に対応した改正等も併せて行う
ものとする。
8 / 12