よむ、つかう、まなぶ。
03【資料1】小児におけるRSウイルス感染症の予防について (16 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_45652.html |
| 出典情報 | 厚生科学審議会予防接種・ワクチン分科会 予防接種基本方針部会 ワクチン評価に関する小委員会(第28回 11/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
RSウイルスに対するワクチン及び抗体製剤
に関する知見等のまとめ②
これまでの知見 ※下線部が今回追記
安全性
論点
ファイザー社母子免疫ワクチン
• 接種後7日間の局所反応は、対照群と比べて介入群で高く、主な局所反
応は注射部位疼痛であった。全身反応は、プラセボ群とワクチン群でお
おむね同程度であった。
• 接種後1か月間で母親参加者と乳児参加者に報告された有害事象や、早産 •
等の周産期の事象の頻度は介入群および対照群で同程度であった。
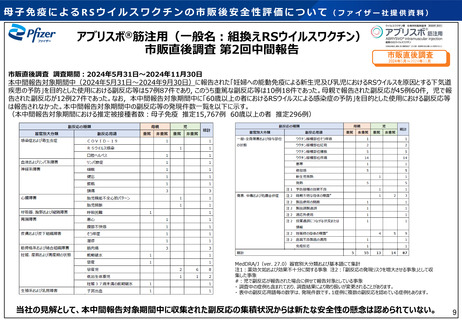
• 我が国の市販後の評価について、審議会(※)における副反応疑い報告
の評価では、現時点で安全性に関する懸念は示されていない。また、市
販直後調査(推定15,767例接種時点)において、10例の重篤な事象(う
ち早産及び早産児計3例、低出生体重児1例)が収集され、企業におい
•
て新たな安全性の懸念は認められていないと評価された。
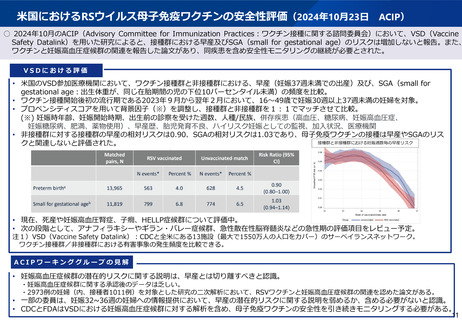
• 米国ACIPにおいて、VAERSに報告された事象は薬事承認前の安全性プロ
ファイルの内容と一貫しており、VSD研究では、背景因子を調節した分
析において早産やSGA(small for gestational age)のリスクは増加し
ないと報告。
• 米国の報告において、接種群において早産やSGAのリスクの上昇は認めな •
かったものの、妊娠高血圧症候群のリスク上昇が報告(ハザード比1.43)
ワクチン及び抗体製剤について、
臨床試験の知見のみならず、市販
後の安全性の情報について、一定
の情報が得られていると考えて良
いか。
我が国の早産等の周産期の事象に
係るベースラインデータについて、
今後安全性評価を行う上で、必要
な情報が明らかになっていると考
えて良いか。
引き続き、審議会(※)の評価及
び、企業において計画されている
市販直後調査・特定使用成績調査
サノフィ/アストラゼネカ社抗体製剤
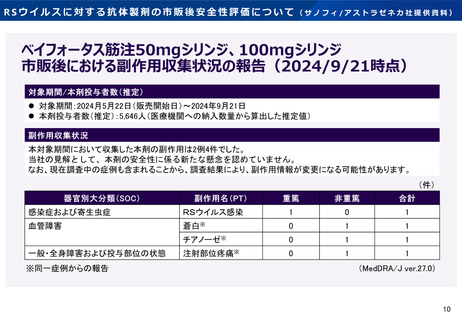
• 接種後360日以内の重篤な有害事象の発現割合について、介入群と対照群
の情報の収集や、米国等の情報を
に有意差はなかった。
収集し検討してはどうか。
• わが国の市販直後調査(推定5,646例接種時点)において、1例の重篤な
• その他、安全性に関する知見につ
事象が収集され、企業において新たな安全性の懸念は認められていない
いてどのような情報が必要と考え
と評価された。
られるか。
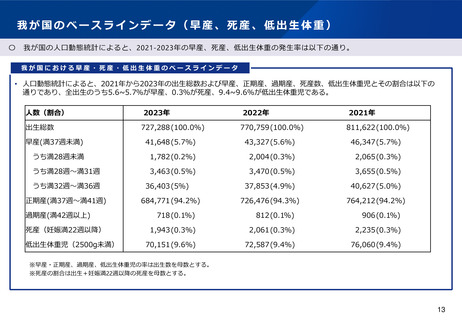
ベースラインデータ
• 人口動態統計において、全出生のうち5.6~5.7%が早産(妊娠37週未
満)、0.3%が死産(妊娠22週以後)、9.4~9.6%が低出生体重児(出生
体重2500g未満)であった(2021~2023年)。
※ 厚生科学審議会予防接種・ワクチン分科会副反応検討部会、薬事審議会医薬品等安全対策部会安全対策調査会(合同開催)
16
に関する知見等のまとめ②
これまでの知見 ※下線部が今回追記
安全性
論点
ファイザー社母子免疫ワクチン
• 接種後7日間の局所反応は、対照群と比べて介入群で高く、主な局所反
応は注射部位疼痛であった。全身反応は、プラセボ群とワクチン群でお
おむね同程度であった。
• 接種後1か月間で母親参加者と乳児参加者に報告された有害事象や、早産 •
等の周産期の事象の頻度は介入群および対照群で同程度であった。
• 我が国の市販後の評価について、審議会(※)における副反応疑い報告
の評価では、現時点で安全性に関する懸念は示されていない。また、市
販直後調査(推定15,767例接種時点)において、10例の重篤な事象(う
ち早産及び早産児計3例、低出生体重児1例)が収集され、企業におい
•
て新たな安全性の懸念は認められていないと評価された。
• 米国ACIPにおいて、VAERSに報告された事象は薬事承認前の安全性プロ
ファイルの内容と一貫しており、VSD研究では、背景因子を調節した分
析において早産やSGA(small for gestational age)のリスクは増加し
ないと報告。
• 米国の報告において、接種群において早産やSGAのリスクの上昇は認めな •
かったものの、妊娠高血圧症候群のリスク上昇が報告(ハザード比1.43)
ワクチン及び抗体製剤について、
臨床試験の知見のみならず、市販
後の安全性の情報について、一定
の情報が得られていると考えて良
いか。
我が国の早産等の周産期の事象に
係るベースラインデータについて、
今後安全性評価を行う上で、必要
な情報が明らかになっていると考
えて良いか。
引き続き、審議会(※)の評価及
び、企業において計画されている
市販直後調査・特定使用成績調査
サノフィ/アストラゼネカ社抗体製剤
• 接種後360日以内の重篤な有害事象の発現割合について、介入群と対照群
の情報の収集や、米国等の情報を
に有意差はなかった。
収集し検討してはどうか。
• わが国の市販直後調査(推定5,646例接種時点)において、1例の重篤な
• その他、安全性に関する知見につ
事象が収集され、企業において新たな安全性の懸念は認められていない
いてどのような情報が必要と考え
と評価された。
られるか。
ベースラインデータ
• 人口動態統計において、全出生のうち5.6~5.7%が早産(妊娠37週未
満)、0.3%が死産(妊娠22週以後)、9.4~9.6%が低出生体重児(出生
体重2500g未満)であった(2021~2023年)。
※ 厚生科学審議会予防接種・ワクチン分科会副反応検討部会、薬事審議会医薬品等安全対策部会安全対策調査会(合同開催)
16