よむ、つかう、まなぶ。
03【資料1】小児におけるRSウイルス感染症の予防について (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_45652.html |
| 出典情報 | 厚生科学審議会予防接種・ワクチン分科会 予防接種基本方針部会 ワクチン評価に関する小委員会(第28回 11/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
第104回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和6年度第7回薬事審議
会医薬品等安全対策部会安全対策調査会(合同開催)における評価
(令和6年10月25日)
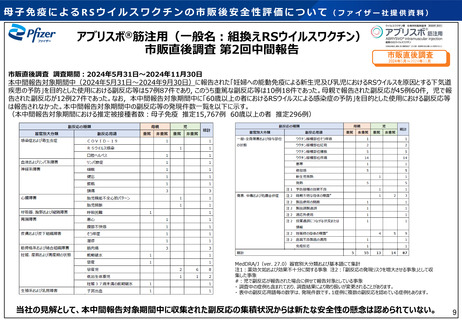
○ 令和6年10月25日に開催された審議会では、母子免疫ワクチンに係る副反応疑い報告について審議され、
現時点で安全性に関する懸念は示されなかった。
【ファイザー社組換えRSウイルスワクチンの副反応疑い報告状況について】
• 集計期間である令和6年4月1日から令和6年6月30日までの医療機関への納入数量から推定した接種可能のべ人
数は2801回であった(接種対象者は妊婦もしくは60歳以上の高齢者)。
• 集計期間における医療機関からの副反応疑い報告数は0件、製造販売業者からの報告は1件であり、副反応疑い
報告の頻度は0.036%であった。
※ 納入されたワクチンが1人当たり1回接種されたと仮定。
• 製造販売業者からの副反応疑い報告1件は重篤例として報告されており、接種から症状発生までの日数は24日
間であった。症状名は「帝王切開」と報告されており、転帰は不明であった。
• 上記の報告状況を踏まえ、審議会において現時点で安全性に関する懸念は示されなかった。
(参照)第104回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和6年度第7回薬事審議会医薬品等安全対策部会安全対策調査会
(合同開催) 資料2-25
8
会医薬品等安全対策部会安全対策調査会(合同開催)における評価
(令和6年10月25日)
○ 令和6年10月25日に開催された審議会では、母子免疫ワクチンに係る副反応疑い報告について審議され、
現時点で安全性に関する懸念は示されなかった。
【ファイザー社組換えRSウイルスワクチンの副反応疑い報告状況について】
• 集計期間である令和6年4月1日から令和6年6月30日までの医療機関への納入数量から推定した接種可能のべ人
数は2801回であった(接種対象者は妊婦もしくは60歳以上の高齢者)。
• 集計期間における医療機関からの副反応疑い報告数は0件、製造販売業者からの報告は1件であり、副反応疑い
報告の頻度は0.036%であった。
※ 納入されたワクチンが1人当たり1回接種されたと仮定。
• 製造販売業者からの副反応疑い報告1件は重篤例として報告されており、接種から症状発生までの日数は24日
間であった。症状名は「帝王切開」と報告されており、転帰は不明であった。
• 上記の報告状況を踏まえ、審議会において現時点で安全性に関する懸念は示されなかった。
(参照)第104回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和6年度第7回薬事審議会医薬品等安全対策部会安全対策調査会
(合同開催) 資料2-25
8