よむ、つかう、まなぶ。
03【資料1】小児におけるRSウイルス感染症の予防について (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_45652.html |
| 出典情報 | 厚生科学審議会予防接種・ワクチン分科会 予防接種基本方針部会 ワクチン評価に関する小委員会(第28回 11/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
母子免疫によるRSウイルスワクチンの市販後安全性評価について(ファイザー社提供資料)
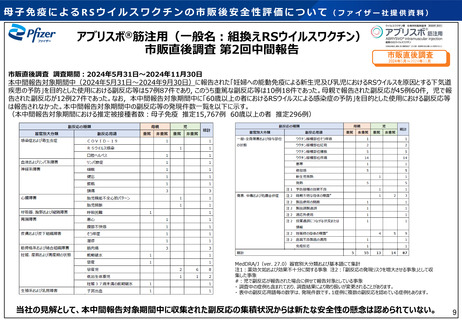
アブリスボ®筋注用(一般名:組換えRSウイルスワクチン)
市販直後調査 第2回中間報告
市販直後調査
2024年5月~2024年11月
市販直後調査 調査期間:2024年5月31日~2024年11月30日
本中間報告対象期間中(2024年5月31日~2024年9月30日)に報告された「妊婦への能動免疫による新生児及び乳児におけるRSウイルスを原因とする下気道
疾患の予防」を目的とした使⽤における副反応等は57例87件であり, このうち重篤な副反応等は10例18件であった。母親で報告された副反応が45例60件,児で報
告された副反応が12例27件であった。なお,本中間報告対象期間中に「60歳以上の者におけるRSウイルスによる感染症の予防」を目的とした使⽤における副反応等
は報告されなかった。本中間報告対象期間中の副反応等の発現件数一覧を以下に示す。
(本中間報告対象期間における推定被接種者数:母子免疫 推定15,767例 60歳以上の者 推定296例)
MedDRA/J(ver. 27.0)器官別大分類および基本語にて集計
注1:薬効欠如および効果不十分に関する事象 注2:「副反応の発現リスクを増大させる事象」として収
集した事象
#:児で副反応が報告された場合に併せて報告対象としている事象
・ 調査中の症例も含まれており、調査結果により取り扱いが変更されることがあります。
・ 表中の副反応⽤語毎の数字は、発現件数です。1症例に複数の副反応を認めている症例もあります。
当社の見解として、本中間報告対象期間中に収集された副反応の集積状況からは新たな安全性の懸念は認められていない。
9
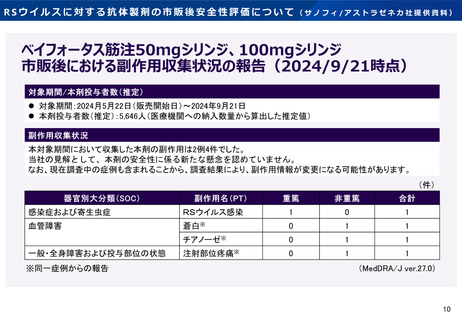
アブリスボ®筋注用(一般名:組換えRSウイルスワクチン)
市販直後調査 第2回中間報告
市販直後調査
2024年5月~2024年11月
市販直後調査 調査期間:2024年5月31日~2024年11月30日
本中間報告対象期間中(2024年5月31日~2024年9月30日)に報告された「妊婦への能動免疫による新生児及び乳児におけるRSウイルスを原因とする下気道
疾患の予防」を目的とした使⽤における副反応等は57例87件であり, このうち重篤な副反応等は10例18件であった。母親で報告された副反応が45例60件,児で報
告された副反応が12例27件であった。なお,本中間報告対象期間中に「60歳以上の者におけるRSウイルスによる感染症の予防」を目的とした使⽤における副反応等
は報告されなかった。本中間報告対象期間中の副反応等の発現件数一覧を以下に示す。
(本中間報告対象期間における推定被接種者数:母子免疫 推定15,767例 60歳以上の者 推定296例)
MedDRA/J(ver. 27.0)器官別大分類および基本語にて集計
注1:薬効欠如および効果不十分に関する事象 注2:「副反応の発現リスクを増大させる事象」として収
集した事象
#:児で副反応が報告された場合に併せて報告対象としている事象
・ 調査中の症例も含まれており、調査結果により取り扱いが変更されることがあります。
・ 表中の副反応⽤語毎の数字は、発現件数です。1症例に複数の副反応を認めている症例もあります。
当社の見解として、本中間報告対象期間中に収集された副反応の集積状況からは新たな安全性の懸念は認められていない。
9