よむ、つかう、まなぶ。
総-2参考2 (19 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_46580.html |
| 出典情報 | 中央社会保険医療協議会 総会(第599回 12/11)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
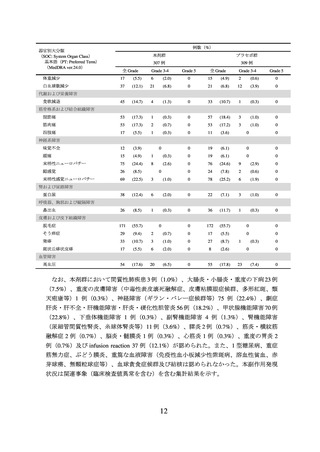
投与対象となる患者
5.
【有効性に関する事項】
① 根治的治療の適応がなく、化学療法歴のない(化学放射線療法としての投与歴は除
く)進行又は再発の子宮頸癌患者において、本剤、パクリタキセル及びプラチナ製剤
(シスプラチン又はカルボプラチン)の併用投与並びに本剤、パクリタキセル、プラチ
ナ製剤(シスプラチン又はカルボプラチン))及びベバシズマブの併用投与の有効性
が示されている。
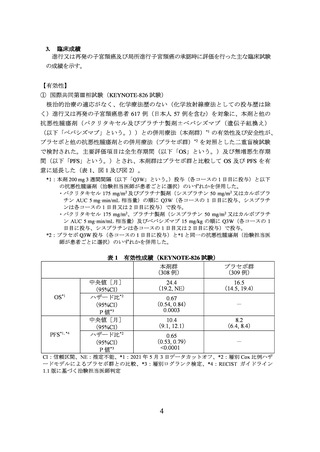
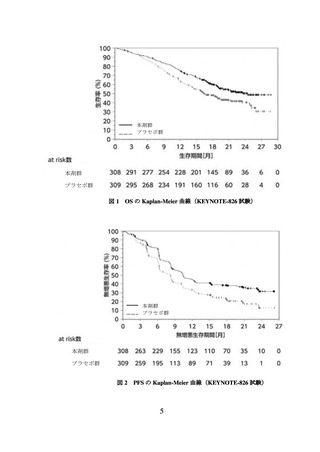
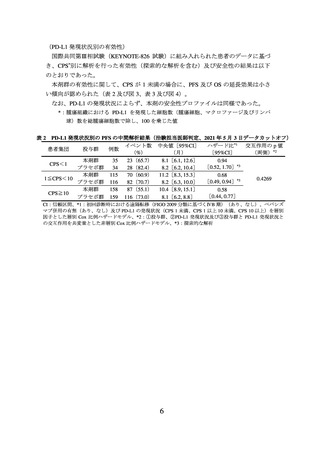
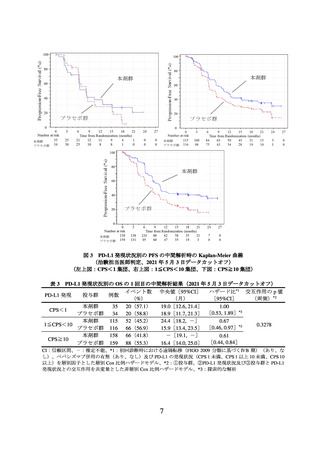
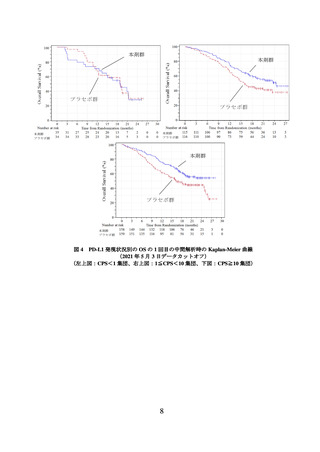
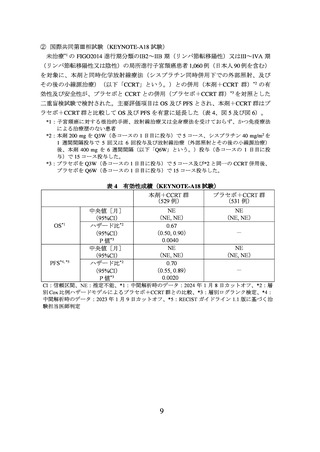
② 進行又は再発の子宮頸癌患者に対しては、国際共同第Ⅲ相試験(KEYNOTE-826 試
験)において、PD-L1 発現率(CPS*)により有効性が異なる傾向が示唆されている
こと(p6~8 参照)から、CPS 別の本剤の有効性について十分に理解した上で適応
患者の選択を行うことが望ましい。CPS が 1 未満であることが確認された患者にお
いては、本剤以外の治療選択肢も考慮する。
*:本剤の診断薬として、PD-L1 IHC 22C3 pharmDx「ダコ」(販売名)が承認されている。
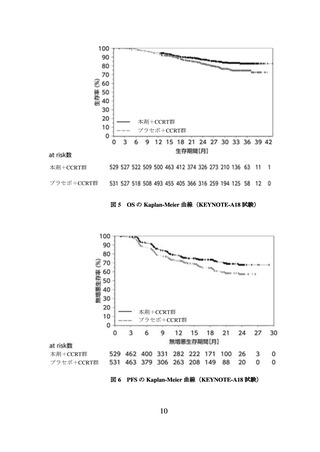
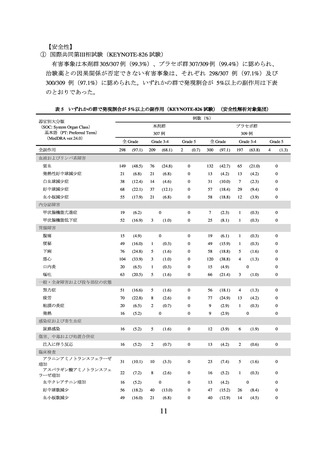
③ 未治療の FIGO2014 進行期分類のⅠB2~ⅡB 期(リンパ節転移陽性)又はⅢ~ⅣA 期
(リンパ節転移陽性又は陰性)の局所進行子宮頸癌患者において、本剤と CCRT(シ
スプラチン同時併用下での外部照射、及びその後の小線源治療)との併用投与の有効
性が示されている。
④ 下記に該当する本剤の投与及び使用方法については、本剤の有効性が確立されておら
ず、本剤の投与対象とならない。
術後補助療法
①又は③で本剤の有効性が示されていない他の抗悪性腫瘍剤との併用投与
【安全性に関する事項】
① 下記に該当する患者については本剤の投与が禁忌とされていることから、投与を
行わないこと。
•
本剤の成分に対し過敏症の既往歴のある患者
② 治験前の評価において下記に該当する患者については、本剤の投与は推奨されな
いが、他の治療選択肢がない場合に限り、慎重に本剤を使用することを考慮でき
る。
•
間質性肺疾患の合併又は既往のある患者
•
胸部画像検査で間質影を認める患者及び活動性の放射線肺臓炎や感染性肺炎等の
18
5.
【有効性に関する事項】
① 根治的治療の適応がなく、化学療法歴のない(化学放射線療法としての投与歴は除
く)進行又は再発の子宮頸癌患者において、本剤、パクリタキセル及びプラチナ製剤
(シスプラチン又はカルボプラチン)の併用投与並びに本剤、パクリタキセル、プラチ
ナ製剤(シスプラチン又はカルボプラチン))及びベバシズマブの併用投与の有効性
が示されている。
② 進行又は再発の子宮頸癌患者に対しては、国際共同第Ⅲ相試験(KEYNOTE-826 試
験)において、PD-L1 発現率(CPS*)により有効性が異なる傾向が示唆されている
こと(p6~8 参照)から、CPS 別の本剤の有効性について十分に理解した上で適応
患者の選択を行うことが望ましい。CPS が 1 未満であることが確認された患者にお
いては、本剤以外の治療選択肢も考慮する。
*:本剤の診断薬として、PD-L1 IHC 22C3 pharmDx「ダコ」(販売名)が承認されている。
③ 未治療の FIGO2014 進行期分類のⅠB2~ⅡB 期(リンパ節転移陽性)又はⅢ~ⅣA 期
(リンパ節転移陽性又は陰性)の局所進行子宮頸癌患者において、本剤と CCRT(シ
スプラチン同時併用下での外部照射、及びその後の小線源治療)との併用投与の有効
性が示されている。
④ 下記に該当する本剤の投与及び使用方法については、本剤の有効性が確立されておら
ず、本剤の投与対象とならない。
術後補助療法
①又は③で本剤の有効性が示されていない他の抗悪性腫瘍剤との併用投与
【安全性に関する事項】
① 下記に該当する患者については本剤の投与が禁忌とされていることから、投与を
行わないこと。
•
本剤の成分に対し過敏症の既往歴のある患者
② 治験前の評価において下記に該当する患者については、本剤の投与は推奨されな
いが、他の治療選択肢がない場合に限り、慎重に本剤を使用することを考慮でき
る。
•
間質性肺疾患の合併又は既往のある患者
•
胸部画像検査で間質影を認める患者及び活動性の放射線肺臓炎や感染性肺炎等の
18