よむ、つかう、まなぶ。
総-2参考2 (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_46580.html |
| 出典情報 | 中央社会保険医療協議会 総会(第599回 12/11)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
3.
臨床成績
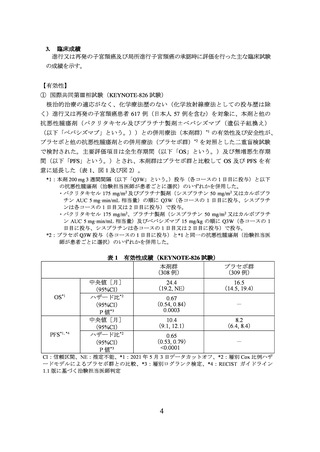
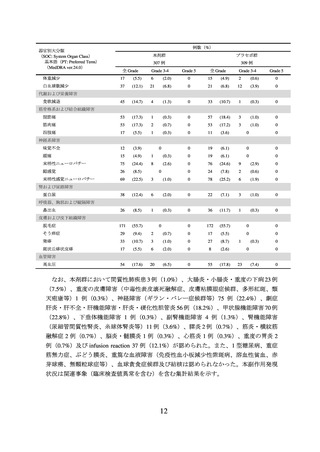
進行又は再発の子宮頸癌及び局所進行子宮頸癌の承認時に評価を行った主な臨床試験
の成績を示す。
【有効性】
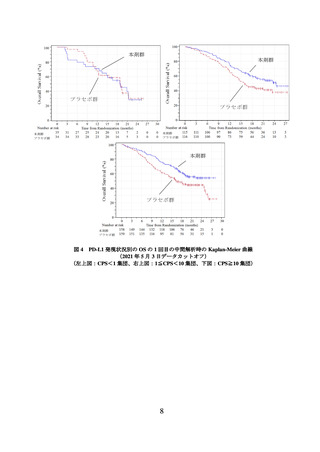
① 国際共同第Ⅲ相試験(KEYNOTE-826 試験)
根治的治療の適応がなく、化学療法歴のない(化学放射線療法としての投与歴は除
く)進行又は再発の子宮頸癌患者 617 例(日本人 57 例を含む)を対象に、本剤と他の
抗悪性腫瘍剤(パクリタキセル及びプラチナ製剤±ベバシズマブ(遺伝子組換え)
(以下「ベバシズマブ」という。))との併用療法(本剤群)*1 の有効性及び安全性が、
プラセボと他の抗悪性腫瘍剤との併用療法(プラセボ群)*2 を対照とした二重盲検試験
で検討された。主要評価項目は全生存期間(以下「OS」という。)及び無増悪生存期
間(以下「PFS」という。)とされ、本剤群はプラセボ群と比較して OS 及び PFS を有
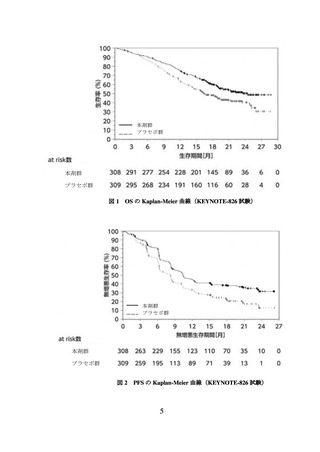
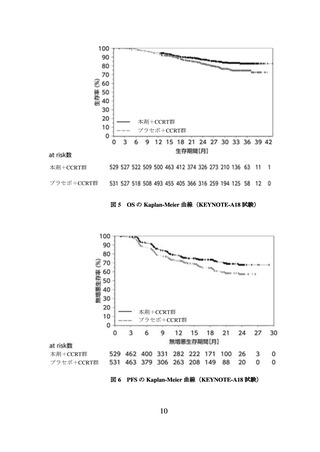
意に延長した(表 1、図 1 及び図 2)。
*1:本剤 200 mg 3 週間間隔(以下「Q3W」という。
)投与(各コースの 1 日目に投与)と以下
の抗悪性腫瘍剤(治験担当医師が患者ごとに選択)のいずれかを併用した。
・パクリタキセル 175 mg/m2 及びプラチナ製剤(シスプラチン 50 mg/m2 又はカルボプラ
チン AUC 5 mg·min/mL 相当量)の順に Q3W(各コースの 1 日目に投与、シスプラチ
ンは各コースの 1 日目又は 2 日目に投与)で投与。
・パクリタキセル 175 mg/m2、プラチナ製剤(シスプラチン 50 mg/m2 又はカルボプラチ
ン AUC 5 mg·min/mL 相当量)及びベバシズマブ 15 mg/kg の順に Q3W(各コースの 1
日目に投与、シスプラチンは各コースの 1 日目又は 2 日目に投与)で投与。
*2:プラセボ Q3W 投与(各コースの 1 日目に投与)と*1 と同一の抗悪性腫瘍剤(治験担当医
師が患者ごとに選択)のいずれかを併用した。
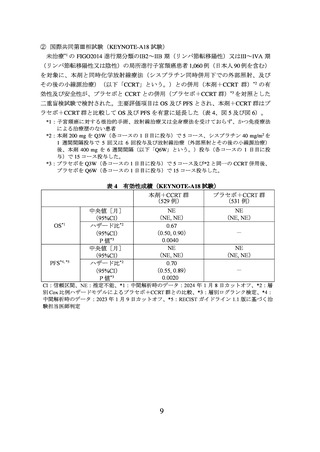
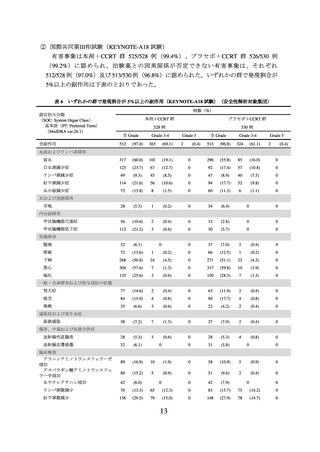
表 1 有効性成績(KEYNOTE-826 試験)
本剤群
プラセボ群
(308 例)
(309 例)
OS*1
PFS*1, *4
中央値[月]
(95%CI)
ハザード比*2
(95%CI)
P 値*3
中央値[月]
(95%CI)
ハザード比*2
(95%CI)
P 値*3
24.4
(19.2, NE)
16.5
(14.5, 19.4)
0.67
(0.54, 0.84)
0.0003
-
10.4
(9.1, 12.1)
8.2
(6.4, 8.4)
0.65
(0.53, 0.79)
<0.0001
-
CI:信頼区間、NE:推定不能、*1:2021 年 5 月 3 日データカットオフ、*2:層別 Cox 比例ハザ
ードモデルによるプラセボ群との比較、*3:層別ログランク検定、*4:RECIST ガイドライン
1.1 版に基づく治験担当医師判定
4
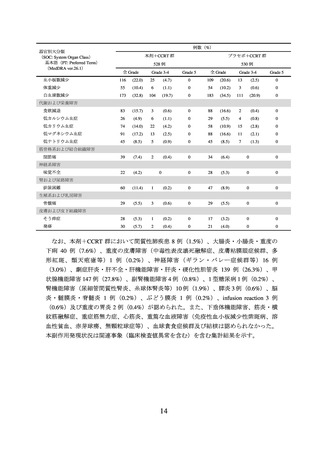
臨床成績
進行又は再発の子宮頸癌及び局所進行子宮頸癌の承認時に評価を行った主な臨床試験
の成績を示す。
【有効性】
① 国際共同第Ⅲ相試験(KEYNOTE-826 試験)
根治的治療の適応がなく、化学療法歴のない(化学放射線療法としての投与歴は除
く)進行又は再発の子宮頸癌患者 617 例(日本人 57 例を含む)を対象に、本剤と他の
抗悪性腫瘍剤(パクリタキセル及びプラチナ製剤±ベバシズマブ(遺伝子組換え)
(以下「ベバシズマブ」という。))との併用療法(本剤群)*1 の有効性及び安全性が、
プラセボと他の抗悪性腫瘍剤との併用療法(プラセボ群)*2 を対照とした二重盲検試験
で検討された。主要評価項目は全生存期間(以下「OS」という。)及び無増悪生存期
間(以下「PFS」という。)とされ、本剤群はプラセボ群と比較して OS 及び PFS を有
意に延長した(表 1、図 1 及び図 2)。
*1:本剤 200 mg 3 週間間隔(以下「Q3W」という。
)投与(各コースの 1 日目に投与)と以下
の抗悪性腫瘍剤(治験担当医師が患者ごとに選択)のいずれかを併用した。
・パクリタキセル 175 mg/m2 及びプラチナ製剤(シスプラチン 50 mg/m2 又はカルボプラ
チン AUC 5 mg·min/mL 相当量)の順に Q3W(各コースの 1 日目に投与、シスプラチ
ンは各コースの 1 日目又は 2 日目に投与)で投与。
・パクリタキセル 175 mg/m2、プラチナ製剤(シスプラチン 50 mg/m2 又はカルボプラチ
ン AUC 5 mg·min/mL 相当量)及びベバシズマブ 15 mg/kg の順に Q3W(各コースの 1
日目に投与、シスプラチンは各コースの 1 日目又は 2 日目に投与)で投与。
*2:プラセボ Q3W 投与(各コースの 1 日目に投与)と*1 と同一の抗悪性腫瘍剤(治験担当医
師が患者ごとに選択)のいずれかを併用した。
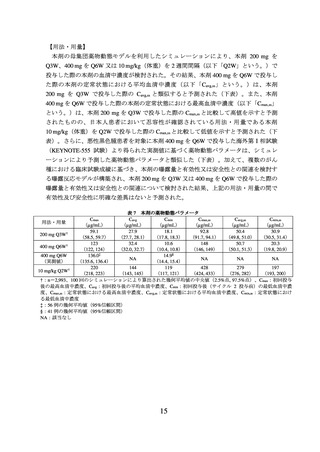
表 1 有効性成績(KEYNOTE-826 試験)
本剤群
プラセボ群
(308 例)
(309 例)
OS*1
PFS*1, *4
中央値[月]
(95%CI)
ハザード比*2
(95%CI)
P 値*3
中央値[月]
(95%CI)
ハザード比*2
(95%CI)
P 値*3
24.4
(19.2, NE)
16.5
(14.5, 19.4)
0.67
(0.54, 0.84)
0.0003
-
10.4
(9.1, 12.1)
8.2
(6.4, 8.4)
0.65
(0.53, 0.79)
<0.0001
-
CI:信頼区間、NE:推定不能、*1:2021 年 5 月 3 日データカットオフ、*2:層別 Cox 比例ハザ
ードモデルによるプラセボ群との比較、*3:層別ログランク検定、*4:RECIST ガイドライン
1.1 版に基づく治験担当医師判定
4