よむ、つかう、まなぶ。
資料1-1 医薬品等の使用上の注意の改訂について[188KB] (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_53729.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第3回 3/14)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
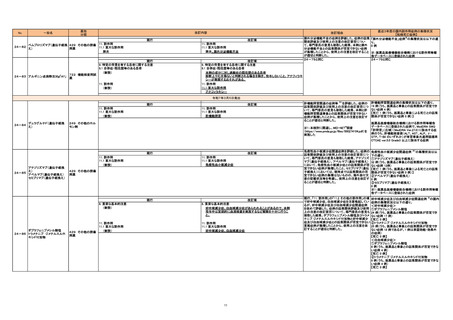
No.
一般名
薬効
分類
改訂内容
現行
改訂案
8. 重要な基本的注意
妊娠する可能性のある女性への投与に際しては、本剤投与の必要性を十
分に検討すること。また、投与が必要な場合には、次の注意事項に留意す
ること。
本剤投与開始前に十分な問診により患者が妊娠していないこと及び妊娠し
ている可能性がないことを確認すること。
次の事項について、本剤投与開始前に患者に説明すること。
・妊娠中に本剤を服用した場合、胎児に影響を及ぼす可能性があること。
・本剤服用中に妊娠が判明した又は疑われる場合は、直ちに服用を中止す
ること。
・本剤服用中及び最終服用後2週間における妊娠が判明した又は疑われる
場合は、速やかに医師、薬剤師等に相談すること。
現行
改訂案
8. 重要な基本的注意
妊娠する可能性のある女性への投与に際しては、本剤投与の必要性を十
分に検討すること。また、投与が必要な場合には、次の注意事項に留意す
ること。
本剤投与開始前に十分な問診により患者が妊娠していないこと及び妊娠し
ている可能性がないことを確認すること。
次の事項について、本剤投与開始前に患者に説明すること。
・妊娠中に本剤を服用した場合、胎児に影響を及ぼす可能性があること。
・本剤服用中に妊娠が判明した又は疑われる場合は、直ちに服用を中止す
ること。
・本剤服用中及び最終服用後4日間における妊娠が判明した又は疑われる
場合は、速やかに医師、薬剤師等に相談すること。
8. 重要な基本的注意
(新設)
24-77 エンシトレルビルフマル酸
625 抗ウイルス剤
(新設)
24-78 モルヌピラビル
625 抗ウイルス剤
ツインパル輸液
24-79 プラスアミノ輸液
アルギU点滴静注20g
現行
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
325 たん白アミノ酸
(新設)
製剤
399 他に分類され
ない代謝性医薬品
11. 副作用
(新設)
直近3年度の国内副作用症例の集積状況
【転帰死亡症例】
改訂理由
令和6年度第9回安全対策調査会(令和6年 12 月 ー
4日)における議論結果等を踏まえ、医薬品の「使
用上の注意」を改訂することが適切と判断した。
24-77と同じ
ー
令和7年1月29日発出
現行
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
(新設)
24-80 ビーフリード輸液
325 たん白アミノ酸
製剤
11. 副作用
11.1 重大な副作用
ショック
血圧降下、胸内苦悶、呼吸困難等があらわれた場合には、直ちに
投与を中止し、適切な処置を行うこと。
改訂案
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
本剤の成分に対し過敏症の既往歴のある患者
治療上やむを得ないと判断される場合を除き、投与しないこと。
アナフィラキシーが発現するおそれがある。
11. 副作用
11.1 重大な副作用
アナフィラキシー
改訂案
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
本剤の成分に対し過敏症の既往歴のある患者(チアミン塩化物塩
酸塩に対し過敏症の既往歴のある患者を除く)
治療上やむを得ないと判断される場合を除き、投与しないこと。
アナフィラキシーが発現するおそれがある。
11. 副作用
11.1 重大な副作用
ショック、アナフィラキシー
血圧降下、胸内苦悶、呼吸困難等があらわれた場合には、直ちに
投与を中止し、適切な処置を行うこと。
現行
11. 副作用
11.1 重大な副作用
(新設)
24-81
エドキサバントシル酸塩水和
物
改訂案
11. 副作用
11.1 重大な副作用
血小板減少症
333 血液凝固阻止
剤
https://www.pmda.go.jp/files/000273493.pdf 参照
24-79と同じ
血小板減少症関連症例を評価した。症例の因果関 血小板減少症関連症例※の集積状況は以下の通
係評価及び使用上の注意の改訂要否について、 り。
専門委員の意見も聴取した結果、本剤と血小板減
少症との因果関係が否定できない症例が集積した 29 例(うち、医薬品と事象との因果関係が否定でき
ことから、使用上の注意を改訂することが適切と判 ない症例 6 例)
断した。
【死亡 2 例(うち、医薬品と事象による死亡との因果
関係が否定できない症例 0 例)】
※:医薬品医療機器総合機構における副作用等報
告データベースに登録された症例であり、MedDRA
ver.27.0 SMQ「造血障害による血小板減少症(狭
域)」で抽出した症例のうち、血小板減少症発現前の
血小板数の記載がないものを除き、血小板減少症発
現後の血小板数の最低値が有害事象共通用語規準
CTCAE ver.5.0 Grade3 以上に該当する症例を抽出
した。
10
一般名
薬効
分類
改訂内容
現行
改訂案
8. 重要な基本的注意
妊娠する可能性のある女性への投与に際しては、本剤投与の必要性を十
分に検討すること。また、投与が必要な場合には、次の注意事項に留意す
ること。
本剤投与開始前に十分な問診により患者が妊娠していないこと及び妊娠し
ている可能性がないことを確認すること。
次の事項について、本剤投与開始前に患者に説明すること。
・妊娠中に本剤を服用した場合、胎児に影響を及ぼす可能性があること。
・本剤服用中に妊娠が判明した又は疑われる場合は、直ちに服用を中止す
ること。
・本剤服用中及び最終服用後2週間における妊娠が判明した又は疑われる
場合は、速やかに医師、薬剤師等に相談すること。
現行
改訂案
8. 重要な基本的注意
妊娠する可能性のある女性への投与に際しては、本剤投与の必要性を十
分に検討すること。また、投与が必要な場合には、次の注意事項に留意す
ること。
本剤投与開始前に十分な問診により患者が妊娠していないこと及び妊娠し
ている可能性がないことを確認すること。
次の事項について、本剤投与開始前に患者に説明すること。
・妊娠中に本剤を服用した場合、胎児に影響を及ぼす可能性があること。
・本剤服用中に妊娠が判明した又は疑われる場合は、直ちに服用を中止す
ること。
・本剤服用中及び最終服用後4日間における妊娠が判明した又は疑われる
場合は、速やかに医師、薬剤師等に相談すること。
8. 重要な基本的注意
(新設)
24-77 エンシトレルビルフマル酸
625 抗ウイルス剤
(新設)
24-78 モルヌピラビル
625 抗ウイルス剤
ツインパル輸液
24-79 プラスアミノ輸液
アルギU点滴静注20g
現行
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
325 たん白アミノ酸
(新設)
製剤
399 他に分類され
ない代謝性医薬品
11. 副作用
(新設)
直近3年度の国内副作用症例の集積状況
【転帰死亡症例】
改訂理由
令和6年度第9回安全対策調査会(令和6年 12 月 ー
4日)における議論結果等を踏まえ、医薬品の「使
用上の注意」を改訂することが適切と判断した。
24-77と同じ
ー
令和7年1月29日発出
現行
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
(新設)
24-80 ビーフリード輸液
325 たん白アミノ酸
製剤
11. 副作用
11.1 重大な副作用
ショック
血圧降下、胸内苦悶、呼吸困難等があらわれた場合には、直ちに
投与を中止し、適切な処置を行うこと。
改訂案
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
本剤の成分に対し過敏症の既往歴のある患者
治療上やむを得ないと判断される場合を除き、投与しないこと。
アナフィラキシーが発現するおそれがある。
11. 副作用
11.1 重大な副作用
アナフィラキシー
改訂案
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
本剤の成分に対し過敏症の既往歴のある患者(チアミン塩化物塩
酸塩に対し過敏症の既往歴のある患者を除く)
治療上やむを得ないと判断される場合を除き、投与しないこと。
アナフィラキシーが発現するおそれがある。
11. 副作用
11.1 重大な副作用
ショック、アナフィラキシー
血圧降下、胸内苦悶、呼吸困難等があらわれた場合には、直ちに
投与を中止し、適切な処置を行うこと。
現行
11. 副作用
11.1 重大な副作用
(新設)
24-81
エドキサバントシル酸塩水和
物
改訂案
11. 副作用
11.1 重大な副作用
血小板減少症
333 血液凝固阻止
剤
https://www.pmda.go.jp/files/000273493.pdf 参照
24-79と同じ
血小板減少症関連症例を評価した。症例の因果関 血小板減少症関連症例※の集積状況は以下の通
係評価及び使用上の注意の改訂要否について、 り。
専門委員の意見も聴取した結果、本剤と血小板減
少症との因果関係が否定できない症例が集積した 29 例(うち、医薬品と事象との因果関係が否定でき
ことから、使用上の注意を改訂することが適切と判 ない症例 6 例)
断した。
【死亡 2 例(うち、医薬品と事象による死亡との因果
関係が否定できない症例 0 例)】
※:医薬品医療機器総合機構における副作用等報
告データベースに登録された症例であり、MedDRA
ver.27.0 SMQ「造血障害による血小板減少症(狭
域)」で抽出した症例のうち、血小板減少症発現前の
血小板数の記載がないものを除き、血小板減少症発
現後の血小板数の最低値が有害事象共通用語規準
CTCAE ver.5.0 Grade3 以上に該当する症例を抽出
した。
10