よむ、つかう、まなぶ。
資料1-1 医薬品等の使用上の注意の改訂について[188KB] (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_53729.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第3回 3/14)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
No.
一般名
薬効
分類
改訂内容
現行
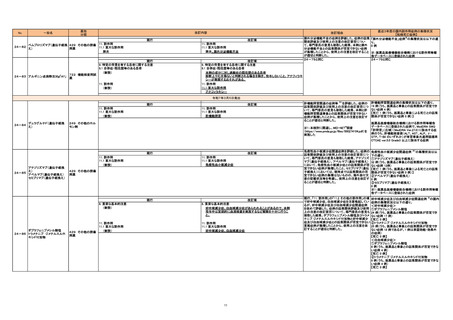
24-82
ペムブロリズマブ(遺伝子組換 429 その他の腫瘍 11. 副作用
11.1 重大な副作用
え)
用薬
膵炎
24-83 アルギニン点滴静注30g「AY」
722 機能検査用試
薬
改訂案
11. 副作用
11.1 重大な副作用
膵炎、膵外分泌機能不全
現行
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
(新設)
11. 副作用
(新設)
改訂案
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
本剤の成分に対し過敏症の既往歴のある患者
診断上やむを得ないと判断される場合を除き、投与しないこと。アナフィラキ
シーが発現するおそれがある。
11. 副作用
11.1 重大な副作用
アナフィラキシー
直近3年度の国内副作用症例の集積状況
改訂理由
【転帰死亡症例】
膵外分泌機能不全の症例を評価した。症例の因果 「膵外分泌機能不全」症例※の集積状況は以下の通
関係評価及び使用上の注意の改訂要否につい
り。
て、専門委員の意見も聴取した結果、本剤と膵外 0 例
分泌機能不全との因果関係が否定できない症例
が集積したことから、使用上の注意を改訂すること ※:医薬品医療機器総合機構における副作用等報
が適切と判断した。
告データベースに登録された症例
24-79と同じ
24-79と同じ
令和7年3月5日発出
現行
11. 副作用
11.1 重大な副作用
(新設)
24-84
デュラグルチド(遺伝子組換
え)
改訂案
11. 副作用
11.1 重大な副作用
肝機能障害
249 その他のホル
モン剤
※1:本検討に関連し、MID-NET®調査
(https://www.pmda.go.jp/files/000274104.pdf)を
実施した
現行
24-85
アテゾリズマブ(遺伝子組換
え)
アベルマブ(遺伝子組換え)
セミプリマブ(遺伝子組換え)
11. 副作用
11.1 重大な副作用
(新設)
改訂案
11. 副作用
11.1 重大な副作用
免疫性血小板減少症
429 その他の腫瘍
用薬
現行
8. 重要な基本的注意
(新設)
ダブラフェニブメシル酸塩
24-86 トラメチニブ ジメチルスルホ
キシド付加物
肝機能障害関連の症例等 ※1を評価した。症例の
因果関係評価及び使用上の注意の改訂要否につ
いて、専門委員の意見も聴取した結果、本剤と肝
機能障害関連事象との因果関係が否定できない
症例が集積したことから、使用上の注意を改訂す
ることが適切と判断した。
11. 副作用
11.1 重大な副作用
(新設)
429 その他の腫瘍
用薬
改訂案
8. 重要な基本的注意
好中球減少症、白血球減少症があらわれることがあるので、本剤
投与中は定期的に血液検査を実施するなど観察を十分に行うこ
と。
11. 副作用
11.1 重大な副作用
好中球減少症、白血球減少症
11
肝機能障害関連症例の集積状況は以下の通り。
19 例(うち、医薬品と事象との因果関係が否定でき
ない症例 4 例)
【死亡 1 例(うち、医薬品と事象による死亡との因果
関係が否定できない症例 0 例)】
医薬品医療機器総合機構における副作用等報告
データベースに登録された症例で、MedDRA SMQ
「肝障害」(広域)(MedDRA Ver.27.0)に該当する症
例のうち、肝機能検査値(ALT、AST、ALP、γGTP、T-Bil のいずれか)が有害事象共通用語規準
CTCAE ver.5.0 Grade3 以上に該当する症例
免疫性血小板減少症関連症例を評価した。症例の 免疫性血小板減少症関連症例 ※1の集積状況は以
因果関係評価及び使用上の注意の改訂要否につ 下の通り。
いて、専門委員の意見も聴取した結果、アテゾリズ ①アテゾリズマブ(遺伝子組換え)
マブ(遺伝子組換え)、アベルマブ(遺伝子組換え) 32 例(うち、医薬品と事象との因果関係が否定でき
において、免疫性血小板減少症との因果関係が否 ない症例 12例)
定できない症例が集積したこと、セミプリマブ(遺伝 【死亡 1 例(うち、医薬品と事象による死亡との因果
子組換え)においては、現時点では因果関係の否 関係が否定できない症例 0 例)】
定できない症例の集積はないものの、海外添付文 ②アベルマブ(遺伝子組換え)
書の記載状況等を考慮し、使用上の注意を改訂す 0 例
ることが適切と判断した。
③セミプリマブ(遺伝子組換え)
0例
※1:医薬品医療機器総合機構における副作用等報
告データベースに登録された症例
現行、「11. 副作用」の「11.2 その他の副作用」の項 好中球減少症及び白血球減少症関連症例 ※の国内
で好中球減少症、白血球減少症を注意喚起してい 症例の集積状況は以下の通り。
るが、好中球減少症及び白血球減少症関連症例 <好中球減少症>
を改めて評価した。症例の因果関係評価及び使用 ①ダブラフェニブメシル酸塩
上の注意の改訂要否について、専門委員の意見も 24 例(うち、医薬品と事象との因果関係が否定でき
聴取した結果、ダブラフェニブメシル酸塩及びトラメ ない症例 17 例)
チニブ ジメチルスルホキシド付加物と好中球減少 【死亡 0 例】
症及び白血球減少症との因果関係が否定できない ②トラメチニブ ジメチルスルホキシド付加物
重篤症例が集積したことから、使用上の注意を改 25 例(うち、医薬品と事象との因果関係が否定でき
訂することが適切と判断した。
ない症例 18 例であるが、1 例は承認効能・効果外
の症例)
【死亡 0 例】
<白血球減少症>
①ダブラフェニブメシル酸塩
8 例(うち、医薬品と事象との因果関係が否定できな
い症例 4 例)
【死亡 0 例】
②トラメチニブ ジメチルスルホキシド付加物
8 例(うち、医薬品と事象との因果関係が否定できな
い症例 4 例)
【死亡 0 例】
一般名
薬効
分類
改訂内容
現行
24-82
ペムブロリズマブ(遺伝子組換 429 その他の腫瘍 11. 副作用
11.1 重大な副作用
え)
用薬
膵炎
24-83 アルギニン点滴静注30g「AY」
722 機能検査用試
薬
改訂案
11. 副作用
11.1 重大な副作用
膵炎、膵外分泌機能不全
現行
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
(新設)
11. 副作用
(新設)
改訂案
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
本剤の成分に対し過敏症の既往歴のある患者
診断上やむを得ないと判断される場合を除き、投与しないこと。アナフィラキ
シーが発現するおそれがある。
11. 副作用
11.1 重大な副作用
アナフィラキシー
直近3年度の国内副作用症例の集積状況
改訂理由
【転帰死亡症例】
膵外分泌機能不全の症例を評価した。症例の因果 「膵外分泌機能不全」症例※の集積状況は以下の通
関係評価及び使用上の注意の改訂要否につい
り。
て、専門委員の意見も聴取した結果、本剤と膵外 0 例
分泌機能不全との因果関係が否定できない症例
が集積したことから、使用上の注意を改訂すること ※:医薬品医療機器総合機構における副作用等報
が適切と判断した。
告データベースに登録された症例
24-79と同じ
24-79と同じ
令和7年3月5日発出
現行
11. 副作用
11.1 重大な副作用
(新設)
24-84
デュラグルチド(遺伝子組換
え)
改訂案
11. 副作用
11.1 重大な副作用
肝機能障害
249 その他のホル
モン剤
※1:本検討に関連し、MID-NET®調査
(https://www.pmda.go.jp/files/000274104.pdf)を
実施した
現行
24-85
アテゾリズマブ(遺伝子組換
え)
アベルマブ(遺伝子組換え)
セミプリマブ(遺伝子組換え)
11. 副作用
11.1 重大な副作用
(新設)
改訂案
11. 副作用
11.1 重大な副作用
免疫性血小板減少症
429 その他の腫瘍
用薬
現行
8. 重要な基本的注意
(新設)
ダブラフェニブメシル酸塩
24-86 トラメチニブ ジメチルスルホ
キシド付加物
肝機能障害関連の症例等 ※1を評価した。症例の
因果関係評価及び使用上の注意の改訂要否につ
いて、専門委員の意見も聴取した結果、本剤と肝
機能障害関連事象との因果関係が否定できない
症例が集積したことから、使用上の注意を改訂す
ることが適切と判断した。
11. 副作用
11.1 重大な副作用
(新設)
429 その他の腫瘍
用薬
改訂案
8. 重要な基本的注意
好中球減少症、白血球減少症があらわれることがあるので、本剤
投与中は定期的に血液検査を実施するなど観察を十分に行うこ
と。
11. 副作用
11.1 重大な副作用
好中球減少症、白血球減少症
11
肝機能障害関連症例の集積状況は以下の通り。
19 例(うち、医薬品と事象との因果関係が否定でき
ない症例 4 例)
【死亡 1 例(うち、医薬品と事象による死亡との因果
関係が否定できない症例 0 例)】
医薬品医療機器総合機構における副作用等報告
データベースに登録された症例で、MedDRA SMQ
「肝障害」(広域)(MedDRA Ver.27.0)に該当する症
例のうち、肝機能検査値(ALT、AST、ALP、γGTP、T-Bil のいずれか)が有害事象共通用語規準
CTCAE ver.5.0 Grade3 以上に該当する症例
免疫性血小板減少症関連症例を評価した。症例の 免疫性血小板減少症関連症例 ※1の集積状況は以
因果関係評価及び使用上の注意の改訂要否につ 下の通り。
いて、専門委員の意見も聴取した結果、アテゾリズ ①アテゾリズマブ(遺伝子組換え)
マブ(遺伝子組換え)、アベルマブ(遺伝子組換え) 32 例(うち、医薬品と事象との因果関係が否定でき
において、免疫性血小板減少症との因果関係が否 ない症例 12例)
定できない症例が集積したこと、セミプリマブ(遺伝 【死亡 1 例(うち、医薬品と事象による死亡との因果
子組換え)においては、現時点では因果関係の否 関係が否定できない症例 0 例)】
定できない症例の集積はないものの、海外添付文 ②アベルマブ(遺伝子組換え)
書の記載状況等を考慮し、使用上の注意を改訂す 0 例
ることが適切と判断した。
③セミプリマブ(遺伝子組換え)
0例
※1:医薬品医療機器総合機構における副作用等報
告データベースに登録された症例
現行、「11. 副作用」の「11.2 その他の副作用」の項 好中球減少症及び白血球減少症関連症例 ※の国内
で好中球減少症、白血球減少症を注意喚起してい 症例の集積状況は以下の通り。
るが、好中球減少症及び白血球減少症関連症例 <好中球減少症>
を改めて評価した。症例の因果関係評価及び使用 ①ダブラフェニブメシル酸塩
上の注意の改訂要否について、専門委員の意見も 24 例(うち、医薬品と事象との因果関係が否定でき
聴取した結果、ダブラフェニブメシル酸塩及びトラメ ない症例 17 例)
チニブ ジメチルスルホキシド付加物と好中球減少 【死亡 0 例】
症及び白血球減少症との因果関係が否定できない ②トラメチニブ ジメチルスルホキシド付加物
重篤症例が集積したことから、使用上の注意を改 25 例(うち、医薬品と事象との因果関係が否定でき
訂することが適切と判断した。
ない症例 18 例であるが、1 例は承認効能・効果外
の症例)
【死亡 0 例】
<白血球減少症>
①ダブラフェニブメシル酸塩
8 例(うち、医薬品と事象との因果関係が否定できな
い症例 4 例)
【死亡 0 例】
②トラメチニブ ジメチルスルホキシド付加物
8 例(うち、医薬品と事象との因果関係が否定できな
い症例 4 例)
【死亡 0 例】