よむ、つかう、まなぶ。
資料1-4 RevMate 改訂案 Ver7.0 (17 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_25755.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和4年度第4回 5/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
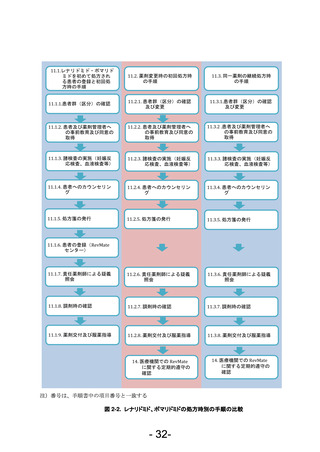
• 処方医師は、薬剤管理者設置を省略可と判断していた患者で、改めて設置要と判断した場合
には、薬剤管理者に対し、患者と同様の教育を行い「レナリドミド・ポマリドミド適正管理
手順に関する同意書(薬剤管理者)(様式 29)」を取得する。
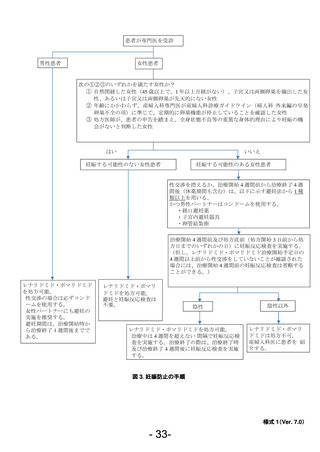
11.2.3. 諸検査の実施(妊娠反応検査、血液検査等)
• C 女性については、治療開始予定日の 4 週間前及び処方直前※1 に医療機関にて妊娠反応検査
※2
を実施し、処方医師は、必ず検査結果が陰性※3 であること、処方日までの 4 週間において、
性交渉を控えるか適切な避妊を実施していることを確認する。但し、治療開始予定日の 4 週
間以上前から性交渉をしていないことが確認された場合には、処方 4 週間前の妊娠反応検査
は省略することができる。
※1
処方開始 3 日前から処方日までのいずれかの日
※2
尿検査:25mIU/mL の感度以上とし、判定は各医療機関の基準に従う。
血液検査:検査項目は β-HCG 又は HCG とし、判定は各医療機関の基準に従う。
※3
妊娠反応検査結果が(擬)陽性の場合は、レナリドミド、ポマリドミドの服用を中止し、
48 時間後、1 週間後、2 週間後及び 3 週間後に妊娠反応検査を実施して、妊娠の有無を確
認する。
・また、すべての患者に対し、血液検査等を実施し、血液毒性等の発現に注意する。
11.2.4. 患者へのカウンセリング
① 処方医師は、患者に対し、RevMate の遵守事項に関する説明やレナリドミド、ポマリドミ
ドによって発現する可能性のある催奇形性等に関して「10.教育及び情報提供」の表 1 資
材一覧に示す資材を用いて説明し、注意喚起を行う。
② 処方医師は、患者が「レブメイト定期確認票(様式 27)」※を持参した場合は、記入内容
を確認した上で必要な説明を行い、「RevMate 遵守状況確認票(様式 20~22)」にて、カ
ウンセリング内容に漏れがないか確認し、医師確認欄にチェックする。
※
「レブメイト定期確認票(様式 27)」については「14. 医療機関での RevMate に関する
定期的遵守の確認」参照。
③ 「レブメイト定期確認票(様式 27)」を記入しない B 女性には、診察時等に「RevMate 遵
守状況確認票(様式 21)」を用いて薬剤管理に関する遵守状況の確認・説明を行う。
11.2.5. 処方箋の発行
① 処方医師は、レナリドミド、ポマリドミド処方時に「RevMate 遵守状況確認票(様式 20~
22)」を用いた患者カウンセリングや妊娠反応検査等の結果等に全く問題がなく、当該患
者に対しレナリドミド、ポマリドミドの処方が適切と判断した場合のみ、必要な数量の薬
剤を処方する。
② 処方医師は、処方箋と共に「レナリドミド・ポマリドミド治療に関する同意書(様式 17~
19)」、「レナリドミド・ポマリドミド適正管理手順に関する同意書(薬剤管理者)(様
式 29)」及び「レブメイト定期確認票(様式 27)」※が責任薬剤師に提出されるよう取り
計らう。
※
患者又は薬剤管理者から「レブメイト定期確認票(様式 27)」を受領した場合は記入内
容を確認した上で必要な説明を行う。
17
- 17-
には、薬剤管理者に対し、患者と同様の教育を行い「レナリドミド・ポマリドミド適正管理
手順に関する同意書(薬剤管理者)(様式 29)」を取得する。
11.2.3. 諸検査の実施(妊娠反応検査、血液検査等)
• C 女性については、治療開始予定日の 4 週間前及び処方直前※1 に医療機関にて妊娠反応検査
※2
を実施し、処方医師は、必ず検査結果が陰性※3 であること、処方日までの 4 週間において、
性交渉を控えるか適切な避妊を実施していることを確認する。但し、治療開始予定日の 4 週
間以上前から性交渉をしていないことが確認された場合には、処方 4 週間前の妊娠反応検査
は省略することができる。
※1
処方開始 3 日前から処方日までのいずれかの日
※2
尿検査:25mIU/mL の感度以上とし、判定は各医療機関の基準に従う。
血液検査:検査項目は β-HCG 又は HCG とし、判定は各医療機関の基準に従う。
※3
妊娠反応検査結果が(擬)陽性の場合は、レナリドミド、ポマリドミドの服用を中止し、
48 時間後、1 週間後、2 週間後及び 3 週間後に妊娠反応検査を実施して、妊娠の有無を確
認する。
・また、すべての患者に対し、血液検査等を実施し、血液毒性等の発現に注意する。
11.2.4. 患者へのカウンセリング
① 処方医師は、患者に対し、RevMate の遵守事項に関する説明やレナリドミド、ポマリドミ
ドによって発現する可能性のある催奇形性等に関して「10.教育及び情報提供」の表 1 資
材一覧に示す資材を用いて説明し、注意喚起を行う。
② 処方医師は、患者が「レブメイト定期確認票(様式 27)」※を持参した場合は、記入内容
を確認した上で必要な説明を行い、「RevMate 遵守状況確認票(様式 20~22)」にて、カ
ウンセリング内容に漏れがないか確認し、医師確認欄にチェックする。
※
「レブメイト定期確認票(様式 27)」については「14. 医療機関での RevMate に関する
定期的遵守の確認」参照。
③ 「レブメイト定期確認票(様式 27)」を記入しない B 女性には、診察時等に「RevMate 遵
守状況確認票(様式 21)」を用いて薬剤管理に関する遵守状況の確認・説明を行う。
11.2.5. 処方箋の発行
① 処方医師は、レナリドミド、ポマリドミド処方時に「RevMate 遵守状況確認票(様式 20~
22)」を用いた患者カウンセリングや妊娠反応検査等の結果等に全く問題がなく、当該患
者に対しレナリドミド、ポマリドミドの処方が適切と判断した場合のみ、必要な数量の薬
剤を処方する。
② 処方医師は、処方箋と共に「レナリドミド・ポマリドミド治療に関する同意書(様式 17~
19)」、「レナリドミド・ポマリドミド適正管理手順に関する同意書(薬剤管理者)(様
式 29)」及び「レブメイト定期確認票(様式 27)」※が責任薬剤師に提出されるよう取り
計らう。
※
患者又は薬剤管理者から「レブメイト定期確認票(様式 27)」を受領した場合は記入内
容を確認した上で必要な説明を行う。
17
- 17-