よむ、つかう、まなぶ。
資料1-4 RevMate 改訂案 Ver7.0 (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_25755.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和4年度第4回 5/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
※2
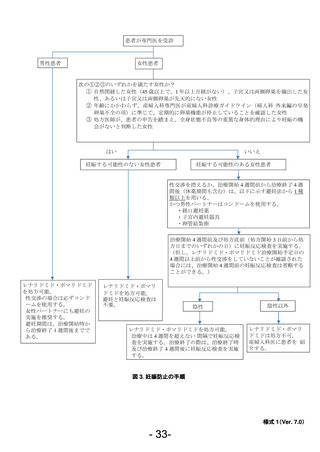
を実施し、処方医師は、必ず検査結果が陰性であること、処方日までの 4 週間において性
交渉を控えるか適切な避妊を実施していることを確認する。但し、レナリドミド、ポマリド
ミド治療開始予定日の 4 週間以上前から性交渉をしていないことが確認された場合には、処
方 4 週間前の 妊娠反応検査は省略することができる。
※1
処方開始 3 日前から処方日までのいずれかの日。
※2
尿検査:25mIU/mL の感度以上とし、判定は各医療機関の基準に従う。
血液検査:検査項目は β-HCG 又は HCG とし、判定は各医療機関の基準に従う。
• 患者の登録には、原則、薬剤管理者の設置を必須とする。薬剤管理者の設置の省略について
は、「3.用語の定義」の項、【薬剤管理者】を参照。
7.
7.1.
申請・登録手順
処方医師の申請・登録手順
7.1.1. 新規に RevMate に登録する医師の場合
① 製造販売業者は、自社製品の適正使用情報等の説明会を開催し、この説明会に出席し、
RevMate に登録を希望する医師の情報を「RevMate 登録申請書(医師)(様式 1)」で
RevMate センターに連絡する。併せて、RevMate に登録を希望した医師に RevMate に関す
る研修の受講が必要であることを伝える。
② RevMate センターは、登録申請を受付け、「RevMate 研修案内書(医師)(様式 2)」を用
いて登録を申請した医師に連絡する。
③ RevMate の登録申請をした医師は、「RevMate 研修案内書(医師)(様式 2)」に従って
RevMate センターが提供する研修を受講し、内容を完全に理解した上で、「RevMate に関す
る同意書(医師・責任薬剤師)(様式 3)」を、RevMate センターに提出する。
④ RevMate センターは、研修を受講し RevMate の遵守に同意した医師に対して「RevMateID
登録通知書(処方医師)(様式 5)」を E-mail 等で送付する。
7.1.2. RevMate に登録があり、新たに別の薬剤を処方する医師の場合
① 製造販売業者は、自社製品の適正使用情報等の説明会を開催し、出席した医師の必要な情
報を「RevMate 登録申請書(医師)(様式 1)」で RevMate センターに連絡する。
② RevMate センターは、医師に「RevMate ID 登録通知書(処方医師)(様式 5)」を E-mail
等で送付する。
7.2.
責任薬剤師の申請・登録手順
7.2.1. 新規に RevMate に登録する責任薬剤師の場合
① 製造販売業者は、自社製品の適正使用情報等の説明会を開催し、出席した責任薬剤師の情
報を「RevMate 登録申請書(薬剤師)(様式 6)」で RevMate センターに連絡する。併せ
て RevMate に登録を申請した責任薬剤師に RevMate に関する研修の受講が必要であること
を伝える。
② RevMate センターは、登録申請を受付け、「RevMate 研修案内書(薬剤師)(様式 7)」を
用いて登録を申請した責任薬剤師に連絡する。
③ RevMate の登録申請をした責任薬剤師は、「RevMate 研修案内書(薬剤師)(様式 7)」に
9
- 9-
を実施し、処方医師は、必ず検査結果が陰性であること、処方日までの 4 週間において性
交渉を控えるか適切な避妊を実施していることを確認する。但し、レナリドミド、ポマリド
ミド治療開始予定日の 4 週間以上前から性交渉をしていないことが確認された場合には、処
方 4 週間前の 妊娠反応検査は省略することができる。
※1
処方開始 3 日前から処方日までのいずれかの日。
※2
尿検査:25mIU/mL の感度以上とし、判定は各医療機関の基準に従う。
血液検査:検査項目は β-HCG 又は HCG とし、判定は各医療機関の基準に従う。
• 患者の登録には、原則、薬剤管理者の設置を必須とする。薬剤管理者の設置の省略について
は、「3.用語の定義」の項、【薬剤管理者】を参照。
7.
7.1.
申請・登録手順
処方医師の申請・登録手順
7.1.1. 新規に RevMate に登録する医師の場合
① 製造販売業者は、自社製品の適正使用情報等の説明会を開催し、この説明会に出席し、
RevMate に登録を希望する医師の情報を「RevMate 登録申請書(医師)(様式 1)」で
RevMate センターに連絡する。併せて、RevMate に登録を希望した医師に RevMate に関す
る研修の受講が必要であることを伝える。
② RevMate センターは、登録申請を受付け、「RevMate 研修案内書(医師)(様式 2)」を用
いて登録を申請した医師に連絡する。
③ RevMate の登録申請をした医師は、「RevMate 研修案内書(医師)(様式 2)」に従って
RevMate センターが提供する研修を受講し、内容を完全に理解した上で、「RevMate に関す
る同意書(医師・責任薬剤師)(様式 3)」を、RevMate センターに提出する。
④ RevMate センターは、研修を受講し RevMate の遵守に同意した医師に対して「RevMateID
登録通知書(処方医師)(様式 5)」を E-mail 等で送付する。
7.1.2. RevMate に登録があり、新たに別の薬剤を処方する医師の場合
① 製造販売業者は、自社製品の適正使用情報等の説明会を開催し、出席した医師の必要な情
報を「RevMate 登録申請書(医師)(様式 1)」で RevMate センターに連絡する。
② RevMate センターは、医師に「RevMate ID 登録通知書(処方医師)(様式 5)」を E-mail
等で送付する。
7.2.
責任薬剤師の申請・登録手順
7.2.1. 新規に RevMate に登録する責任薬剤師の場合
① 製造販売業者は、自社製品の適正使用情報等の説明会を開催し、出席した責任薬剤師の情
報を「RevMate 登録申請書(薬剤師)(様式 6)」で RevMate センターに連絡する。併せ
て RevMate に登録を申請した責任薬剤師に RevMate に関する研修の受講が必要であること
を伝える。
② RevMate センターは、登録申請を受付け、「RevMate 研修案内書(薬剤師)(様式 7)」を
用いて登録を申請した責任薬剤師に連絡する。
③ RevMate の登録申請をした責任薬剤師は、「RevMate 研修案内書(薬剤師)(様式 7)」に
9
- 9-