よむ、つかう、まなぶ。
参考資料4 (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00016.html |
| 出典情報 | 患者申出療養評価会議(第30回 1/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
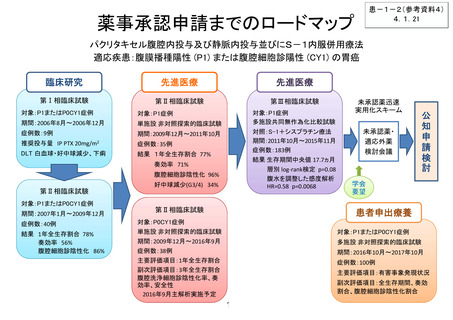
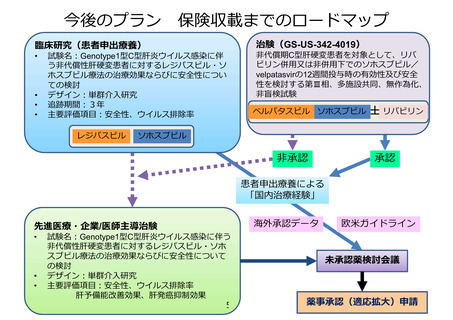
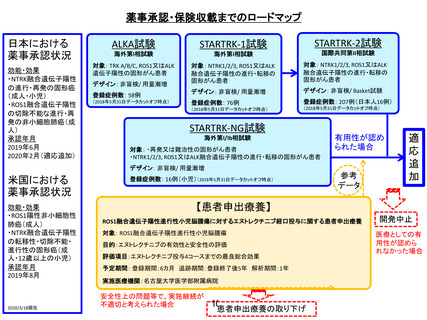
薬事承認申請までのロードマップ
パクリタキセル腹腔内投与及び静脈内投与並びにS-1内服併用療法
適応疾患:腹膜播種陽性 (P1) または腹腔細胞診陽性 (CY1) の胃癌
臨床研究
先進医療
先進医療
第Ⅰ相臨床試験
第Ⅱ相臨床試験
第Ⅲ相臨床試験
対象:P1またはP0CY1症例
対象:P1症例
期間:2006年8月~2006年12月
単施設 非対照探索的臨床試験
症例数:9例
期間:2009年12月~2011年10月
推奨投与量 IP PTX 20mg/m2
症例数:35例
DLT 白血球・好中球減少、下痢
結果 1年全生存割合 77%
対象:P1症例
多施設共同無作為化比較試験
対照:S-1+シスプラチン療法
期間:2011年10月~2015年11月
症例数:183例
結果 生存期間中央値 17.7ヵ月
層別 log-rank検定 p=0.08
腹水を調整した感度解析
HR=0.58 p=0.0068
奏効率 71%
腹腔細胞診陰性化 96%
第Ⅱ相臨床試験
対象:P1またはP0CY1症例
期間:2007年1月~2009年12月
症例数:40例
結果 1年全生存割合 78%
奏効率 56%
腹腔細胞診陰性化 86%
好中球減少(G3/4) 34%
第Ⅱ相臨床試験
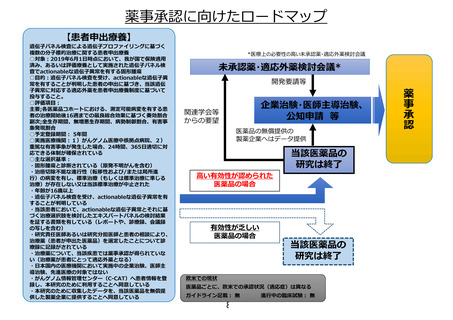
未承認薬迅速
実用化スキーム
未承認薬・
適応外薬
検討会議
公
知
申
請
検
討
学会
要望
患者申出療養
対象:P0CY1症例
単施設 非対照探索的臨床試験
対象:P1またはP0CY1症例
期間:2009年12月~2016年9月
多施設 非対照探索的臨床試験
症例数:38例
主要評価項目:1年全生存割合
副次評価項目:3年全生存割合
腹腔洗浄細胞診陰性化率、奏
効率、安全性
2016年9月主解析実施予定
期間:2016年10月~2017年10月
症例数:100例
主要評価項目:有害事象発現状況
副次評価項目:全生存期間、奏効
割合、腹腔細胞診陰性化割合
1
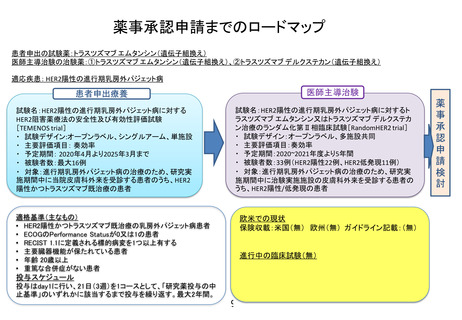
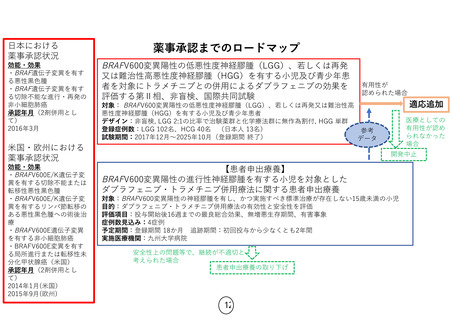
パクリタキセル腹腔内投与及び静脈内投与並びにS-1内服併用療法
適応疾患:腹膜播種陽性 (P1) または腹腔細胞診陽性 (CY1) の胃癌
臨床研究
先進医療
先進医療
第Ⅰ相臨床試験
第Ⅱ相臨床試験
第Ⅲ相臨床試験
対象:P1またはP0CY1症例
対象:P1症例
期間:2006年8月~2006年12月
単施設 非対照探索的臨床試験
症例数:9例
期間:2009年12月~2011年10月
推奨投与量 IP PTX 20mg/m2
症例数:35例
DLT 白血球・好中球減少、下痢
結果 1年全生存割合 77%
対象:P1症例
多施設共同無作為化比較試験
対照:S-1+シスプラチン療法
期間:2011年10月~2015年11月
症例数:183例
結果 生存期間中央値 17.7ヵ月
層別 log-rank検定 p=0.08
腹水を調整した感度解析
HR=0.58 p=0.0068
奏効率 71%
腹腔細胞診陰性化 96%
第Ⅱ相臨床試験
対象:P1またはP0CY1症例
期間:2007年1月~2009年12月
症例数:40例
結果 1年全生存割合 78%
奏効率 56%
腹腔細胞診陰性化 86%
好中球減少(G3/4) 34%
第Ⅱ相臨床試験
未承認薬迅速
実用化スキーム
未承認薬・
適応外薬
検討会議
公
知
申
請
検
討
学会
要望
患者申出療養
対象:P0CY1症例
単施設 非対照探索的臨床試験
対象:P1またはP0CY1症例
期間:2009年12月~2016年9月
多施設 非対照探索的臨床試験
症例数:38例
主要評価項目:1年全生存割合
副次評価項目:3年全生存割合
腹腔洗浄細胞診陰性化率、奏
効率、安全性
2016年9月主解析実施予定
期間:2016年10月~2017年10月
症例数:100例
主要評価項目:有害事象発現状況
副次評価項目:全生存期間、奏効
割合、腹腔細胞診陰性化割合
1