よむ、つかう、まなぶ。
参考資料4 (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00016.html |
| 出典情報 | 患者申出療養評価会議(第30回 1/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
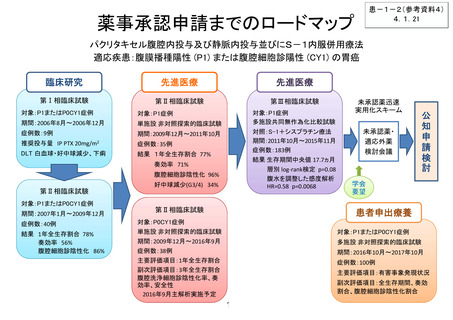
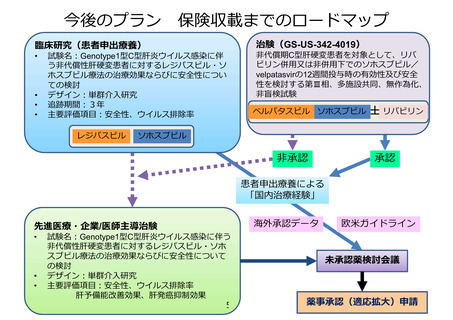
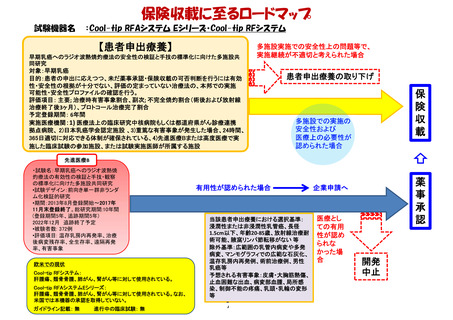
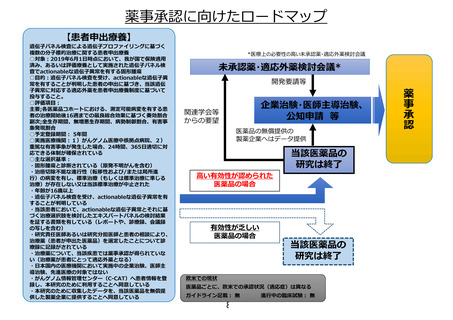
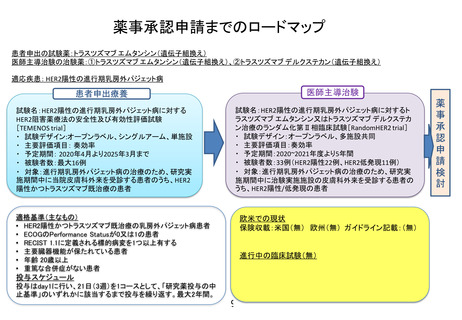
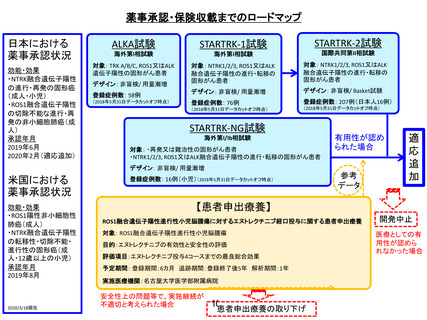
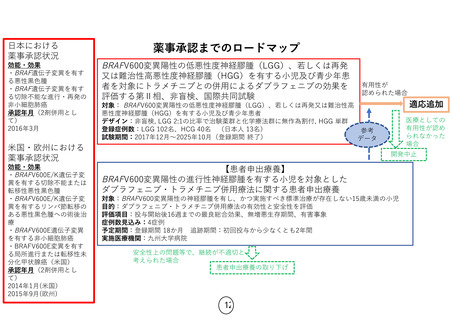
薬事承認申請までのロードマップ
患者申出の試験薬:トラスツズマブ エムタンシン(遺伝子組換え)
医師主導治験の治験薬:①トラスツズマブ エムタンシン(遺伝子組換え)、②トラスツズマブ デルクステカン(遺伝子組換え)
適応疾患: HER2陽性の進行期乳房外パジェット病
医師主導治験
患者申出療養
試験名:HER2陽性の進行期乳房外パジェット病に対するト
ラスツズマブ エムタンシン又はトラスツズマブ デルクステカ
ン治療のランダム化第Ⅱ相臨床試験[RandomHER2 trial]
・ 試験デザイン:オープンラベル、多施設共同
・ 主要評価項目:奏効率
・ 予定期間:2020~2021年度より5年間
・ 被験者数:33例(HER2陽性22例、HER2低発現11例)
・ 対象:進行期乳房外パジェット病の治療のため、研究実
施期間中に治験実施施設の皮膚科外来を受診する患者の
うち、HER2陽性/低発現の患者
試験名:HER2陽性の進行期乳房外パジェット病に対する
HER2阻害薬療法の安全性及び有効性評価試験
[TEMENOS trial]
・ 試験デザイン:オープンラベル、シングルアーム、単施設
・ 主要評価項目: 奏効率
・ 予定期間: 2020年4月より2025年3月まで
・ 被験者数:最大16例
・ 対象:進行期乳房外パジェット病の治療のため、研究実
施期間中に当院皮膚科外来を受診する患者のうち、HER2
陽性かつトラスツズマブ既治療の患者
適格基準(主なもの)
• HER2陽性かつトラスツズマブ既治療の乳房外パジェット病患者
• ECOGのPerformance Statusが0又は1の患者
• RECIST 1.1に定義される標的病変を1つ以上有する
• 主要臓器機能が保たれている患者
• 年齢 20歳以上
• 重篤な合併症がない患者
欧米での現状
保険収載:米国(無) 欧州(無) ガイドライン記載:(無)
進行中の臨床試験(無)
投与スケジュール
投与はday1に行い、21日(3週)を1コースとして、「研究薬投与の中
止基準」のいずれかに該当するまで投与を繰り返す。最大2年間。
9
薬
事
承
認
申
請
検
討
患者申出の試験薬:トラスツズマブ エムタンシン(遺伝子組換え)
医師主導治験の治験薬:①トラスツズマブ エムタンシン(遺伝子組換え)、②トラスツズマブ デルクステカン(遺伝子組換え)
適応疾患: HER2陽性の進行期乳房外パジェット病
医師主導治験
患者申出療養
試験名:HER2陽性の進行期乳房外パジェット病に対するト
ラスツズマブ エムタンシン又はトラスツズマブ デルクステカ
ン治療のランダム化第Ⅱ相臨床試験[RandomHER2 trial]
・ 試験デザイン:オープンラベル、多施設共同
・ 主要評価項目:奏効率
・ 予定期間:2020~2021年度より5年間
・ 被験者数:33例(HER2陽性22例、HER2低発現11例)
・ 対象:進行期乳房外パジェット病の治療のため、研究実
施期間中に治験実施施設の皮膚科外来を受診する患者の
うち、HER2陽性/低発現の患者
試験名:HER2陽性の進行期乳房外パジェット病に対する
HER2阻害薬療法の安全性及び有効性評価試験
[TEMENOS trial]
・ 試験デザイン:オープンラベル、シングルアーム、単施設
・ 主要評価項目: 奏効率
・ 予定期間: 2020年4月より2025年3月まで
・ 被験者数:最大16例
・ 対象:進行期乳房外パジェット病の治療のため、研究実
施期間中に当院皮膚科外来を受診する患者のうち、HER2
陽性かつトラスツズマブ既治療の患者
適格基準(主なもの)
• HER2陽性かつトラスツズマブ既治療の乳房外パジェット病患者
• ECOGのPerformance Statusが0又は1の患者
• RECIST 1.1に定義される標的病変を1つ以上有する
• 主要臓器機能が保たれている患者
• 年齢 20歳以上
• 重篤な合併症がない患者
欧米での現状
保険収載:米国(無) 欧州(無) ガイドライン記載:(無)
進行中の臨床試験(無)
投与スケジュール
投与はday1に行い、21日(3週)を1コースとして、「研究薬投与の中
止基準」のいずれかに該当するまで投与を繰り返す。最大2年間。
9
薬
事
承
認
申
請
検
討