よむ、つかう、まなぶ。
参考資料4 (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00016.html |
| 出典情報 | 患者申出療養評価会議(第30回 1/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
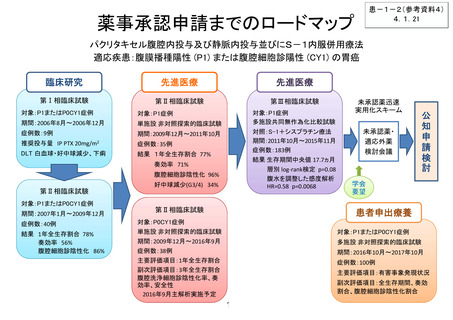
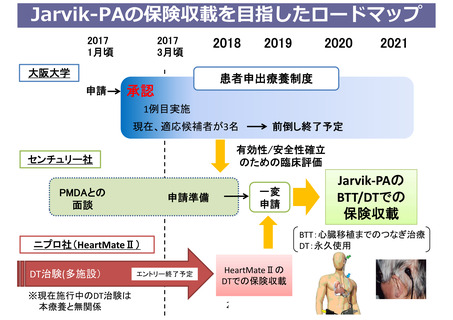
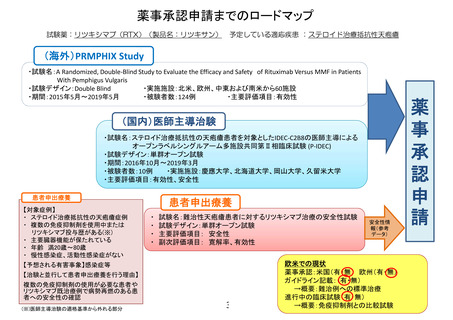
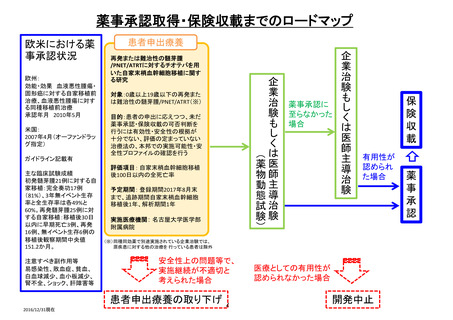
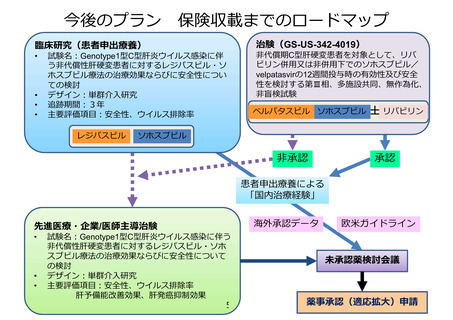
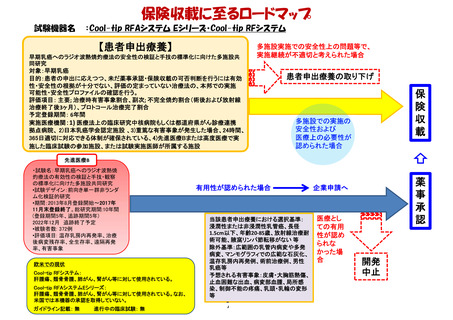
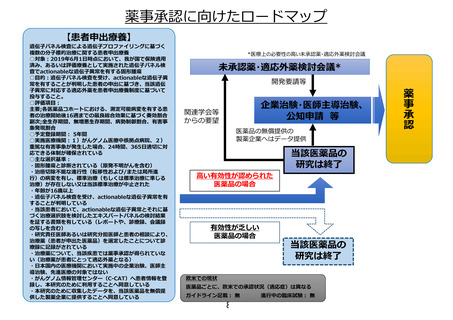
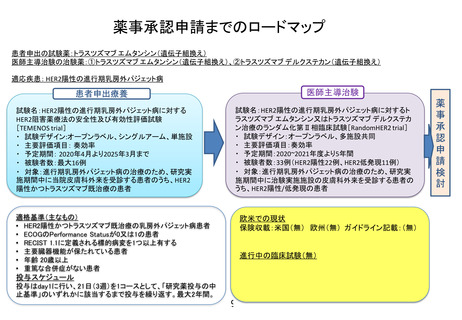
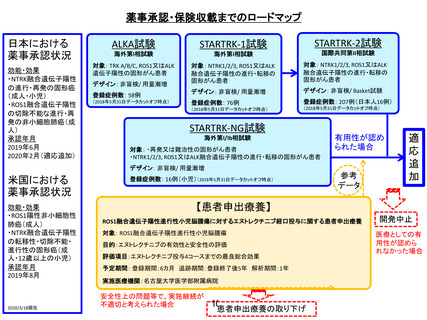
薬事承認取得・保険収載までのロードマップ
米国:
2007年4月(オーファンドラッ
グ指定)
ガイドライン記載有
主な臨床試験成績
初発髄芽腫21例に対する自
家移植:完全奏功17例
(81%)、3年無イベント生存
率と全生存率は各49%と
60%。再発髄芽腫25例に対
する自家移植:移植後30日
以内に早期死亡3例、再発
16例、無イベント生存6例の
移植後観察期間中央値
151.2か月。
注意すべき副作用等
易感染性、敗血症、貧血、
白血球減少、血小板減少、
腎不全、ショック、肝障害等
2016/12/31現在
再発または難治性の髄芽腫
/PNET/ATRTに対するチオテパを用
いた自家末梢血幹細胞移植に関す
る研究
対象:0歳以上19歳以下の再発また
は難治性の髄芽腫/PNET/ATRT(※)
目的:患者の申出に応えつつ、未だ
薬事承認・保険収載の可否判断を
行うには有効性・安全性の根拠が
十分でない、評価の定まっていない
治療法の、本邦での実施可能性・安
全性プロファイルの確認を行う
評価項目: 自家末梢血幹細胞移植
後100日以内の全死亡率
予定期間: 登録期間2017年8月末
まで、追跡期間自家末梢血幹細胞
移植後1年、解析期間1年
実施医療機関: 名古屋大学医学部
附属病院
企業治験もしくは医師主導治験
(薬物動態試験)
欧州:
効能・効果 血液悪性腫瘍・
固形癌に対する自家移植前
治療、血液悪性腫瘍に対す
る同種移植前治療
承認年月 2010年5月
患者申出療養
薬事承認に
至らなかった
場合
企業治験もしくは医師主導治験
欧米における薬
事承認状況
保
険
収
載
有用性が
認められ
た場合
(※)同種同効薬で別途実施されている企業治験では、
原疾患に対する他の治療を 行っている患者は除外
安全性上の問題等で、
実施継続が不適切と
考えられた場合
患者申出療養の取り下げ 4
医療としての有用性が
認められなかった場合
開発中止
薬
事
承
認
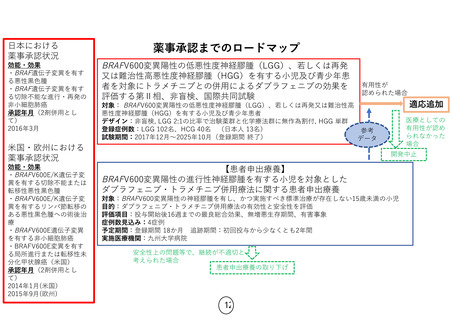
米国:
2007年4月(オーファンドラッ
グ指定)
ガイドライン記載有
主な臨床試験成績
初発髄芽腫21例に対する自
家移植:完全奏功17例
(81%)、3年無イベント生存
率と全生存率は各49%と
60%。再発髄芽腫25例に対
する自家移植:移植後30日
以内に早期死亡3例、再発
16例、無イベント生存6例の
移植後観察期間中央値
151.2か月。
注意すべき副作用等
易感染性、敗血症、貧血、
白血球減少、血小板減少、
腎不全、ショック、肝障害等
2016/12/31現在
再発または難治性の髄芽腫
/PNET/ATRTに対するチオテパを用
いた自家末梢血幹細胞移植に関す
る研究
対象:0歳以上19歳以下の再発また
は難治性の髄芽腫/PNET/ATRT(※)
目的:患者の申出に応えつつ、未だ
薬事承認・保険収載の可否判断を
行うには有効性・安全性の根拠が
十分でない、評価の定まっていない
治療法の、本邦での実施可能性・安
全性プロファイルの確認を行う
評価項目: 自家末梢血幹細胞移植
後100日以内の全死亡率
予定期間: 登録期間2017年8月末
まで、追跡期間自家末梢血幹細胞
移植後1年、解析期間1年
実施医療機関: 名古屋大学医学部
附属病院
企業治験もしくは医師主導治験
(薬物動態試験)
欧州:
効能・効果 血液悪性腫瘍・
固形癌に対する自家移植前
治療、血液悪性腫瘍に対す
る同種移植前治療
承認年月 2010年5月
患者申出療養
薬事承認に
至らなかった
場合
企業治験もしくは医師主導治験
欧米における薬
事承認状況
保
険
収
載
有用性が
認められ
た場合
(※)同種同効薬で別途実施されている企業治験では、
原疾患に対する他の治療を 行っている患者は除外
安全性上の問題等で、
実施継続が不適切と
考えられた場合
患者申出療養の取り下げ 4
医療としての有用性が
認められなかった場合
開発中止
薬
事
承
認