よむ、つかう、まなぶ。
参考資料4 (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00016.html |
| 出典情報 | 患者申出療養評価会議(第30回 1/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
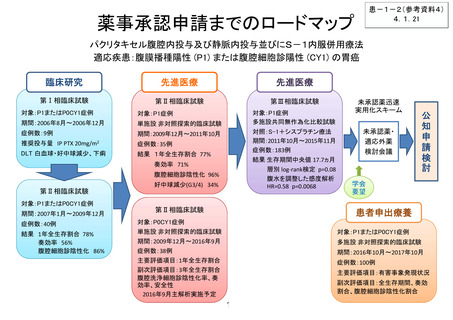
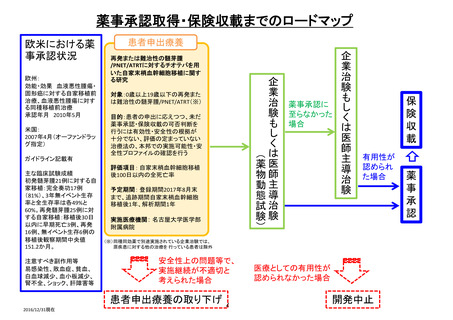
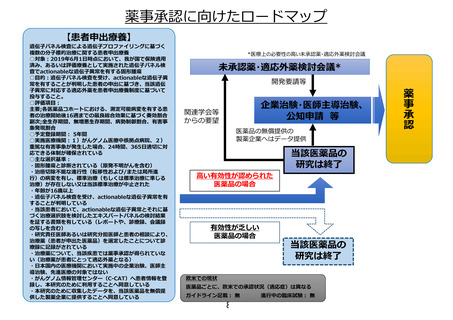
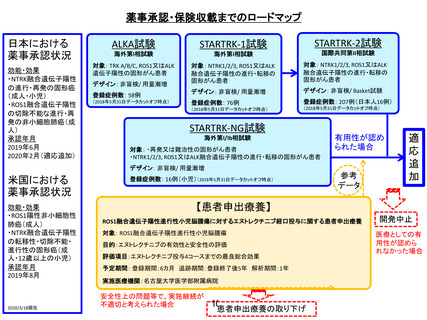
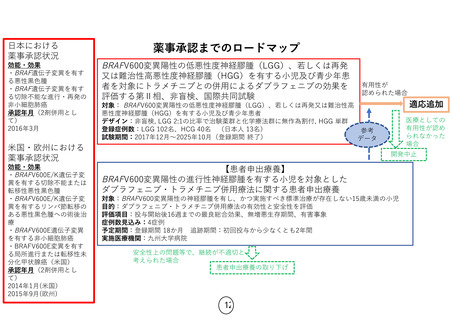
薬事承認に向けたロードマップ
【患者申出療養】
*医療上の必要性の高い未承認薬・適応外薬検討会議
未承認薬・適応外薬検討会議*
開発要請等
企業治験・医師主導治験、
公知申請 等
関連学会等
からの要望
医薬品の無償提供の
製薬企業へはデータ提供
高い有効性が認められた
医薬品の場合
有効性が乏しい
医薬品の場合
当該医薬品の
研究は終了
当該医薬品の
研究は終了
欧米での現状
医薬品ごとに、欧米での承認状況(適応症)は異なる
ガイドライン記載: 無
8
進行中の臨床試験: 無
薬事承認
遺伝子パネル検査による遺伝子プロファイリングに基づく
複数の分子標的治療に関する患者申出療養
○対象:2019年6月1日時点において、我が国で保険適用
済み、あるいは評価療養として実施された遺伝子パネル検
査でactionableな遺伝子異常を有する固形腫瘍
○目的:遺伝子パネル検査を受け、actionableな遺伝子異
常を有することが判明した患者の申出に基づき、当該遺伝
子異常に対応する適応外薬を患者申出療養制度に基づいて
投与すること。
○評価項目:
主要;各医薬品コホートにおける、測定可能病変を有する患
者の治療開始後16週までの最良総合効果に基づく奏効割合
副次;全生存期間、無増悪生存期間、病勢制御割合、有害事
象発現割合
○予定登録期間: 5年間
○実施医療機関:1)がんゲノム医療中核拠点病院、2)
重篤な有害事象が発生した場合、24時間、365日適切に対
応できる体制が確保されている
○主な選択基準:
・固形腫瘍と診断されている(原発不明がんを含む)
・治癒切除不能な進行性(転移性および/または局所進
行)の病変を有し、標準治療(もしくは標準治療に準じる
治療)が存在しない又は当該標準治療が中止された
・年齢が16歳以上
・遺伝子パネル検査を受け、actionableな遺伝子異常を有
することが判明している
・当該患者において、actionableな遺伝子異常とそれに基
づく治療選択肢を検討したエキスパートパネルの検討結果
を証する書類を有している(レポートや、診療録、会議録
の写しを含む)
・研究責任医師あるいは研究分担医師と患者の相談により、
治療薬(患者が申出た医薬品)を選定したことについて診
療録に記録がされている
・治療薬について、当該疾患では薬事承認が得られていな
い(治療薬が患者にとって適応外薬となる)
・日本国内の医療機関において実施中の企業治験、医師主
導治験、先進医療の対象ではない
・がんゲノム情報管理センター(C-CAT)へ患者情報を登
録し、本研究のために利用することへ同意している
・本研究のために収集したデータを、当該医薬品を無償提
供した製薬企業に提供することへ同意している
【患者申出療養】
*医療上の必要性の高い未承認薬・適応外薬検討会議
未承認薬・適応外薬検討会議*
開発要請等
企業治験・医師主導治験、
公知申請 等
関連学会等
からの要望
医薬品の無償提供の
製薬企業へはデータ提供
高い有効性が認められた
医薬品の場合
有効性が乏しい
医薬品の場合
当該医薬品の
研究は終了
当該医薬品の
研究は終了
欧米での現状
医薬品ごとに、欧米での承認状況(適応症)は異なる
ガイドライン記載: 無
8
進行中の臨床試験: 無
薬事承認
遺伝子パネル検査による遺伝子プロファイリングに基づく
複数の分子標的治療に関する患者申出療養
○対象:2019年6月1日時点において、我が国で保険適用
済み、あるいは評価療養として実施された遺伝子パネル検
査でactionableな遺伝子異常を有する固形腫瘍
○目的:遺伝子パネル検査を受け、actionableな遺伝子異
常を有することが判明した患者の申出に基づき、当該遺伝
子異常に対応する適応外薬を患者申出療養制度に基づいて
投与すること。
○評価項目:
主要;各医薬品コホートにおける、測定可能病変を有する患
者の治療開始後16週までの最良総合効果に基づく奏効割合
副次;全生存期間、無増悪生存期間、病勢制御割合、有害事
象発現割合
○予定登録期間: 5年間
○実施医療機関:1)がんゲノム医療中核拠点病院、2)
重篤な有害事象が発生した場合、24時間、365日適切に対
応できる体制が確保されている
○主な選択基準:
・固形腫瘍と診断されている(原発不明がんを含む)
・治癒切除不能な進行性(転移性および/または局所進
行)の病変を有し、標準治療(もしくは標準治療に準じる
治療)が存在しない又は当該標準治療が中止された
・年齢が16歳以上
・遺伝子パネル検査を受け、actionableな遺伝子異常を有
することが判明している
・当該患者において、actionableな遺伝子異常とそれに基
づく治療選択肢を検討したエキスパートパネルの検討結果
を証する書類を有している(レポートや、診療録、会議録
の写しを含む)
・研究責任医師あるいは研究分担医師と患者の相談により、
治療薬(患者が申出た医薬品)を選定したことについて診
療録に記録がされている
・治療薬について、当該疾患では薬事承認が得られていな
い(治療薬が患者にとって適応外薬となる)
・日本国内の医療機関において実施中の企業治験、医師主
導治験、先進医療の対象ではない
・がんゲノム情報管理センター(C-CAT)へ患者情報を登
録し、本研究のために利用することへ同意している
・本研究のために収集したデータを、当該医薬品を無償提
供した製薬企業に提供することへ同意している