よむ、つかう、まなぶ。
参考資料4 (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00016.html |
| 出典情報 | 患者申出療養評価会議(第30回 1/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
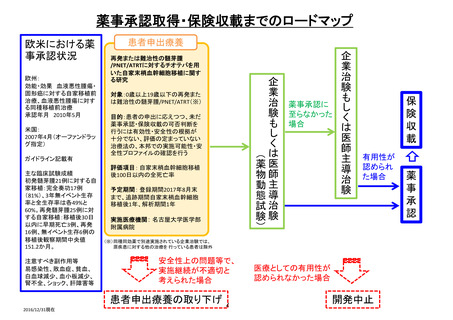
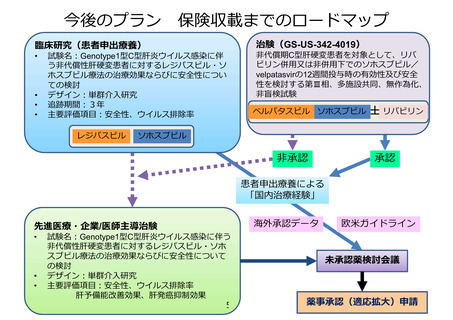
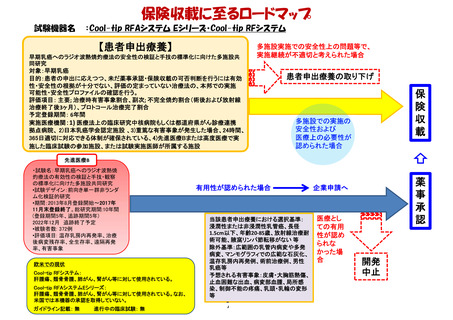
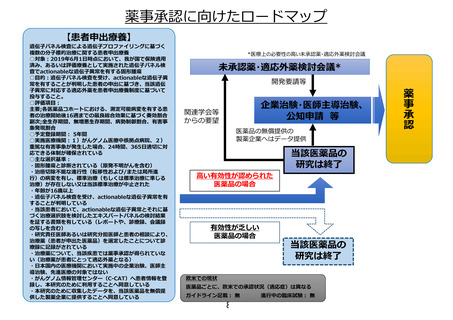
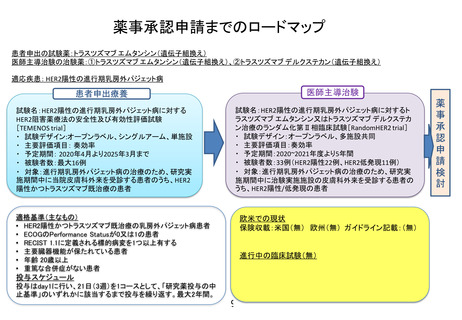
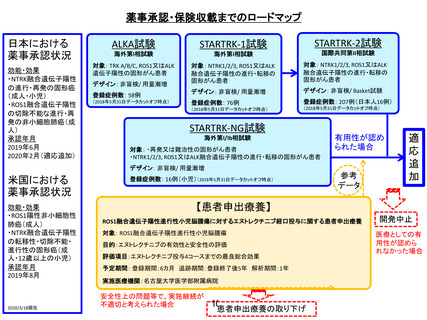
薬事承認取得・保険収載までのロードマップ
これまでの治験状況
<海外PhaseⅠ>
<国内PhaseⅠ>
• 日本人パート6名(FGFR陽性進行固形がん):• 投与実績:208名(FGFR陽性進行固形がん)
50mg QD4名,100mg QD2名、DLTなし
• 最大耐用量:125㎎ QD
― 投与継続症例:1名(内分泌腫瘍50mgQD) • 推奨用量:125㎎ 3 weeks on/1 week off
• 日本人の最大耐用量・推奨用量:未決定
<海外投与継続症例>
― 日本人の忍容性確認用量:50㎎QD
• 投与継続症例:11名
― 100㎎ QD実施途中で登録中止(症例集積
― 米国、ドイツ、スペイン
困難)
― 胆管がん(8)、腎細胞がん(1)、膠芽腫(2)
• 平成30年12月国内治験終了に伴い治験薬提供
― Compassionate use program(non ICH-GCP)
停止 → 患者申出療養を希望
に移行予定
患者申出療養
•
線維芽細胞増殖因子受容体に変化が認められる進行固形がんを有する日本人患者を対象と
したインフィグラチニブ経口投与の長期安全性試験
― 対象:線維芽細胞増殖因子受容体に変化を認めたインフィグラチニブ既治療の進行固
形がん患者
― 目的: インフィグラチニブの長期投与における安全性評価
― 評価項目:高リン酸血症の長期投与における推移、および晩期毒性
― 予定期間:登録期間6カ月,観察期間5年,解析期間1年
― 実施医療機関:名古屋大学医学部附属病院
実施継続が不適切と
判断した場合
患者申出療養の取り下げ
企業治験もしくは医師主導治験
薬事承認
6
有用性が認められない場合は開発中止
保険収載
これまでの治験状況
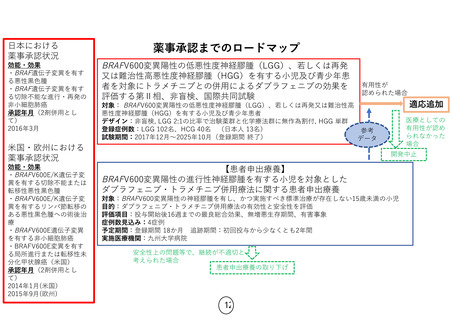
<海外PhaseⅠ>
<国内PhaseⅠ>
• 日本人パート6名(FGFR陽性進行固形がん):• 投与実績:208名(FGFR陽性進行固形がん)
50mg QD4名,100mg QD2名、DLTなし
• 最大耐用量:125㎎ QD
― 投与継続症例:1名(内分泌腫瘍50mgQD) • 推奨用量:125㎎ 3 weeks on/1 week off
• 日本人の最大耐用量・推奨用量:未決定
<海外投与継続症例>
― 日本人の忍容性確認用量:50㎎QD
• 投与継続症例:11名
― 100㎎ QD実施途中で登録中止(症例集積
― 米国、ドイツ、スペイン
困難)
― 胆管がん(8)、腎細胞がん(1)、膠芽腫(2)
• 平成30年12月国内治験終了に伴い治験薬提供
― Compassionate use program(non ICH-GCP)
停止 → 患者申出療養を希望
に移行予定
患者申出療養
•
線維芽細胞増殖因子受容体に変化が認められる進行固形がんを有する日本人患者を対象と
したインフィグラチニブ経口投与の長期安全性試験
― 対象:線維芽細胞増殖因子受容体に変化を認めたインフィグラチニブ既治療の進行固
形がん患者
― 目的: インフィグラチニブの長期投与における安全性評価
― 評価項目:高リン酸血症の長期投与における推移、および晩期毒性
― 予定期間:登録期間6カ月,観察期間5年,解析期間1年
― 実施医療機関:名古屋大学医学部附属病院
実施継続が不適切と
判断した場合
患者申出療養の取り下げ
企業治験もしくは医師主導治験
薬事承認
6
有用性が認められない場合は開発中止
保険収載