よむ、つかう、まなぶ。
参考資料4 (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00016.html |
| 出典情報 | 患者申出療養評価会議(第30回 1/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
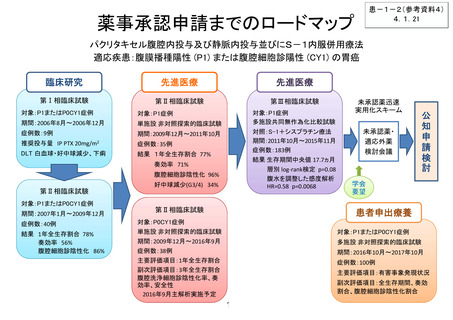
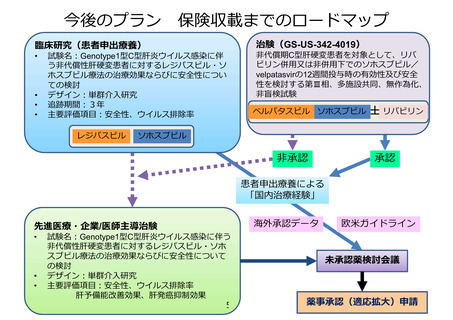
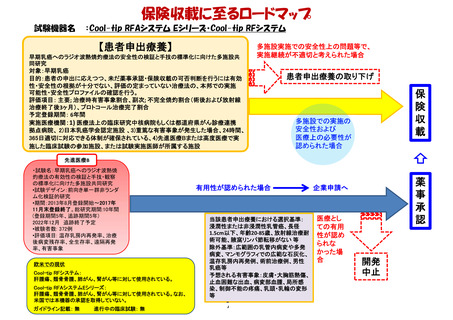
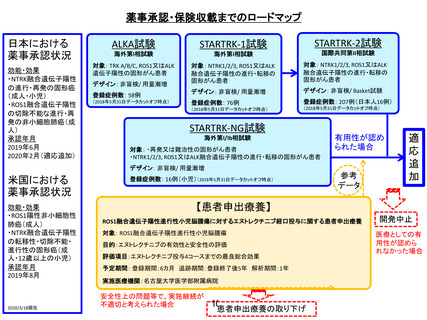
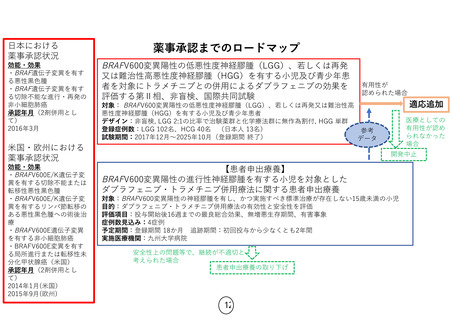
薬事承認・保険収載までのロードマップ
日本における
薬事承認状況
効能・効果
・NTRK融合遺伝子陽性
の進行・再発の固形癌
(成人・小児)
・ROS1融合遺伝子陽性
の切除不能な進行・再
発の非小細胞肺癌(成
人)
承認年月
2019年6月
2020年2月(適応追加)
ALKA試験
海外第I相試験
対象: TRK A/B/C, ROS1又はALK
遺伝子陽性の固形がん患者
デザイン: 非盲検/ 用量漸増
登録症例数: 58例
(2018年5月31日データカットオフ時点)
STARTRK-2試験
STARTRK-1試験
国際共同第II相試験
海外第I相試験
対象: NTRK1/2/3, ROS1又はALK
融合遺伝子陽性の進行・転移の
固形がん患者
対象: NTRK1/2/3, ROS1又はALK
融合遺伝子陽性の進行・転移の
固形がん患者
デザイン: 非盲検/ 用量漸増
デザイン: 非盲検/ Basket試験
登録症例数: 76例
登録症例数: 207例(日本人16例)
(2018年5月31日データカットオフ時点)
(2018年5月31日データカットオフ時点)
STARTRK-NG試験
海外第I/Ib相試験
対象: ・再発又は難治性の固形がん患者
・NTRK1/2/3, ROS1又はALK融合遺伝子陽性の進行・転移の固形がん患者
有用性が認め
られた場合
デザイン: 非盲検/ 用量漸増
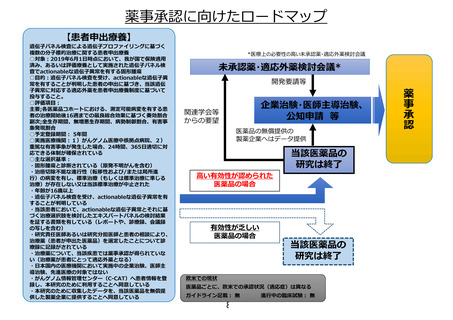
米国における
薬事承認状況
効能・効果
・ROS1陽性非小細胞性
肺癌(成人)
・NTRK融合遺伝子陽性
の転移性・切除不能・
進行性の固形癌(成
人・12歳以上の小児)
承認年月
2019年8月
2020/3/18現在
登録症例数: 16例(小児)(2018年5月31日データカットオフ時点)
参考
データ
適
応
追
加
【患者申出療養】
ROS1融合遺伝子陽性進行性小児脳腫瘍に対するエヌトレクチ二ブ経口投与に関する患者申出療養
対象: ROS1融合遺伝子陽性進行性小児脳腫瘍
目的:エヌトレクチニブの有効性と安全性の評価
評価項目:エヌトレクチニブ投与4コースまでの最良総合効果
予定期間: 登録期間:6カ月 追跡期間:登録終了後5年 解析期間:1年
実施医療機関:名古屋大学医学部附属病院
安全性上の問題等で、実施継続が
不適切と考えられた場合
10
患者申出療養の取り下げ
開発中止
医療としての有
用性が認めら
れなかった場合
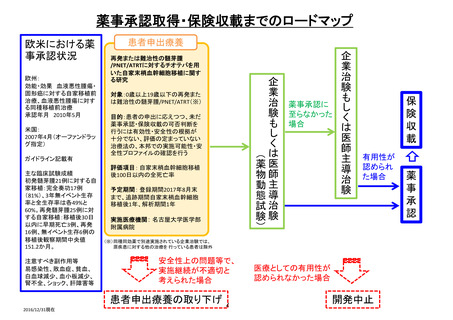
日本における
薬事承認状況
効能・効果
・NTRK融合遺伝子陽性
の進行・再発の固形癌
(成人・小児)
・ROS1融合遺伝子陽性
の切除不能な進行・再
発の非小細胞肺癌(成
人)
承認年月
2019年6月
2020年2月(適応追加)
ALKA試験
海外第I相試験
対象: TRK A/B/C, ROS1又はALK
遺伝子陽性の固形がん患者
デザイン: 非盲検/ 用量漸増
登録症例数: 58例
(2018年5月31日データカットオフ時点)
STARTRK-2試験
STARTRK-1試験
国際共同第II相試験
海外第I相試験
対象: NTRK1/2/3, ROS1又はALK
融合遺伝子陽性の進行・転移の
固形がん患者
対象: NTRK1/2/3, ROS1又はALK
融合遺伝子陽性の進行・転移の
固形がん患者
デザイン: 非盲検/ 用量漸増
デザイン: 非盲検/ Basket試験
登録症例数: 76例
登録症例数: 207例(日本人16例)
(2018年5月31日データカットオフ時点)
(2018年5月31日データカットオフ時点)
STARTRK-NG試験
海外第I/Ib相試験
対象: ・再発又は難治性の固形がん患者
・NTRK1/2/3, ROS1又はALK融合遺伝子陽性の進行・転移の固形がん患者
有用性が認め
られた場合
デザイン: 非盲検/ 用量漸増
米国における
薬事承認状況
効能・効果
・ROS1陽性非小細胞性
肺癌(成人)
・NTRK融合遺伝子陽性
の転移性・切除不能・
進行性の固形癌(成
人・12歳以上の小児)
承認年月
2019年8月
2020/3/18現在
登録症例数: 16例(小児)(2018年5月31日データカットオフ時点)
参考
データ
適
応
追
加
【患者申出療養】
ROS1融合遺伝子陽性進行性小児脳腫瘍に対するエヌトレクチ二ブ経口投与に関する患者申出療養
対象: ROS1融合遺伝子陽性進行性小児脳腫瘍
目的:エヌトレクチニブの有効性と安全性の評価
評価項目:エヌトレクチニブ投与4コースまでの最良総合効果
予定期間: 登録期間:6カ月 追跡期間:登録終了後5年 解析期間:1年
実施医療機関:名古屋大学医学部附属病院
安全性上の問題等で、実施継続が
不適切と考えられた場合
10
患者申出療養の取り下げ
開発中止
医療としての有
用性が認めら
れなかった場合