よむ、つかう、まなぶ。
参考資料4 (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00016.html |
| 出典情報 | 患者申出療養評価会議(第30回 1/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
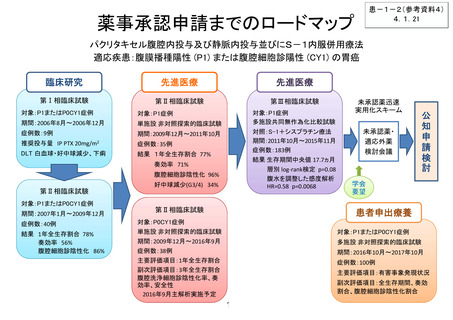
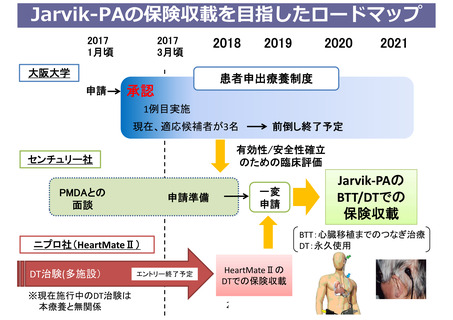
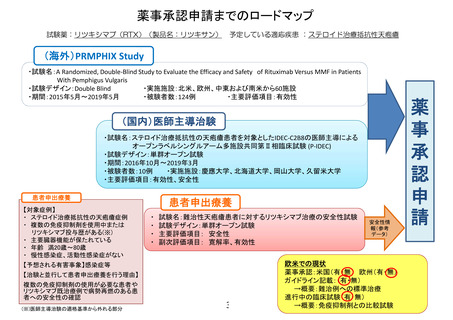
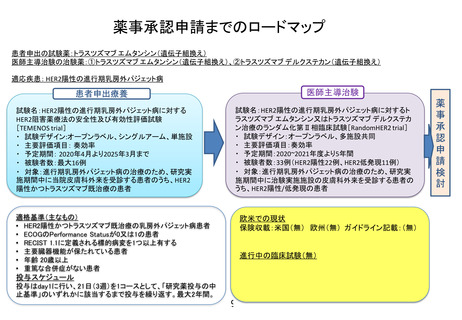
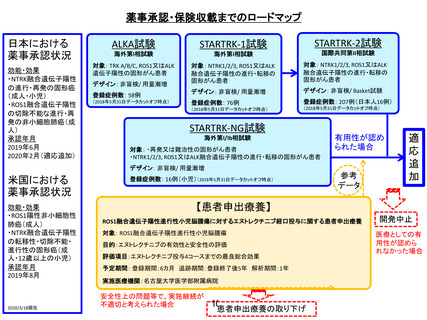
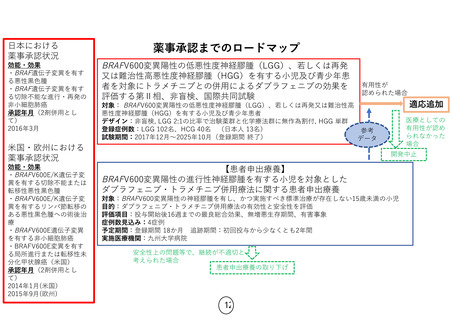
薬事承認申請までのロードマップ
試験薬:リツキシマブ(RTX)(製品名:リツキサン)
予定している適応疾患 :ステロイド治療抵抗性天疱瘡
(海外)PRMPHIX Study
・試験名:A Randomized, Double-Blind Study to Evaluate the Efficacy and Safety of Rituximab Versus MMF in Patients
With Pemphigus Vulgaris
・試験デザイン:Double Blind
・実施施設:北米、欧州、中東および南米から60施設
・期間:2015年5月~2019年5月
・被験者数:124例
・主要評価項目:有効性
(国内)医師主導治験
・試験名:ステロイド治療抵抗性の天疱瘡患者を対象としたIDEC-C2B8の医師主導による
オープンラベルシングルアーム多施設共同第Ⅱ相臨床試験 (P-IDEC)
・試験デザイン:単群オープン試験
・期間:2016年10月~2019年3月
・被験者数:10例
・実施施設:慶應大学、北海道大学、岡山大学、久留米大学
・主要評価項目:有効性、安全性
患者申出療養
【対象症例】
・ ステロイド治療抵抗性の天疱瘡症例
・ 複数の免疫抑制剤を使用中または
リツキシマブ投与歴がある(※)
・ 主要臓器機能が保たれている
・ 年齢 満20歳〜80歳
・ 慢性感染症、活動性感染症がない
患者申出療養
・
・
・
・
試験名:難治性天疱瘡患者に対するリツキシマブ治療の安全性試験
試験デザイン:単群オープン試験
主要評価項目: 安全性
副次評価項目: 寛解率、有効性
【予想される有害事象】感染症等
【治験と並行して患者申出療養を行う理由】
複数の免疫抑制剤の使用が必要な患者や
リツキシマブ既治療例で病勢再燃のある患
者への安全性の確認
(※)医師主導治験の適格基準から外れる部分
3
安全性情
報(参考
データ)
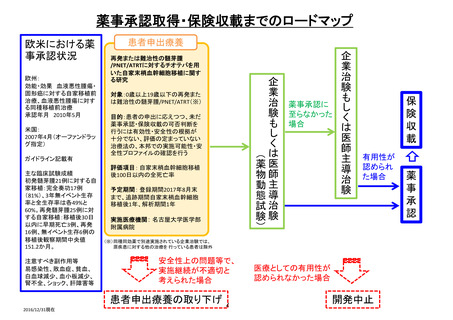
欧米での現状
薬事承認:米国(有・無) 欧州(有・無)
ガイドライン記載:(有・無)
→概要:難治例への標準治療
進行中の臨床試験(有・無)
→概要:免疫抑制剤との比較試験
薬
事
承
認
申
請
試験薬:リツキシマブ(RTX)(製品名:リツキサン)
予定している適応疾患 :ステロイド治療抵抗性天疱瘡
(海外)PRMPHIX Study
・試験名:A Randomized, Double-Blind Study to Evaluate the Efficacy and Safety of Rituximab Versus MMF in Patients
With Pemphigus Vulgaris
・試験デザイン:Double Blind
・実施施設:北米、欧州、中東および南米から60施設
・期間:2015年5月~2019年5月
・被験者数:124例
・主要評価項目:有効性
(国内)医師主導治験
・試験名:ステロイド治療抵抗性の天疱瘡患者を対象としたIDEC-C2B8の医師主導による
オープンラベルシングルアーム多施設共同第Ⅱ相臨床試験 (P-IDEC)
・試験デザイン:単群オープン試験
・期間:2016年10月~2019年3月
・被験者数:10例
・実施施設:慶應大学、北海道大学、岡山大学、久留米大学
・主要評価項目:有効性、安全性
患者申出療養
【対象症例】
・ ステロイド治療抵抗性の天疱瘡症例
・ 複数の免疫抑制剤を使用中または
リツキシマブ投与歴がある(※)
・ 主要臓器機能が保たれている
・ 年齢 満20歳〜80歳
・ 慢性感染症、活動性感染症がない
患者申出療養
・
・
・
・
試験名:難治性天疱瘡患者に対するリツキシマブ治療の安全性試験
試験デザイン:単群オープン試験
主要評価項目: 安全性
副次評価項目: 寛解率、有効性
【予想される有害事象】感染症等
【治験と並行して患者申出療養を行う理由】
複数の免疫抑制剤の使用が必要な患者や
リツキシマブ既治療例で病勢再燃のある患
者への安全性の確認
(※)医師主導治験の適格基準から外れる部分
3
安全性情
報(参考
データ)
欧米での現状
薬事承認:米国(有・無) 欧州(有・無)
ガイドライン記載:(有・無)
→概要:難治例への標準治療
進行中の臨床試験(有・無)
→概要:免疫抑制剤との比較試験
薬
事
承
認
申
請